
將一定質量的金屬鋅投入63.7g稀硫酸中,恰好完全反應,放出氣體的質量與反應時間的關系如圖所示.試求(計算結果精確到0.1%):
(1)完全反應后生成氫氣的質量為 g
(2)所用硫酸溶液中溶質的質量分數
(3)反應結束后所得溶液的質量.
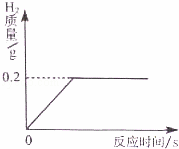
| (1)根據放出氣體的質量與反應時間的關系讀出生成的氫氣的質量; (2)根據鋅與稀硫酸反應的方程式,由氫氣的質量求出參加反應鋅、硫酸溶液中溶質的質量,根據溶質的質量分數的計算公式,計算出所用硫酸溶液中溶質的質量分數; (3)根據質量守恒定律計算出反應結束后所得溶液的質量. | |
| 解答: | 解:(1)由放出氣體的質量與反應時間的關系圖可知,生成氫氣的質量為0.2g; (2)設參加反應鋅、硫酸溶液中溶質的質量分別為x、y Zn+H2SO4=ZnSO4+H2↑ 65 98 2 x y 0.2g
解得:x=6.5g y=9.8g 所用硫酸溶液中溶質的質量分數為: (3)由質量守恒定律可知,反應結束后所得溶液的質量為:63.7g+6.5g﹣0.2g=70g. 故答為:(1)0.2g;(2)所用硫酸溶液中溶質的質量分數是15.4%;(3)反應結束后所得溶液的質量是70g. |


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:初中化學 來源: 題型:
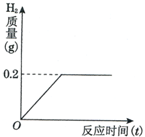 將一定質量的金屬鋅投入93.7克的稀硫酸中恰好完全反應,放出氣體的質量與反應時間(t)的關系如圖所示.請你據此分析計算:
將一定質量的金屬鋅投入93.7克的稀硫酸中恰好完全反應,放出氣體的質量與反應時間(t)的關系如圖所示.請你據此分析計算:查看答案和解析>>
科目:初中化學 來源: 題型:
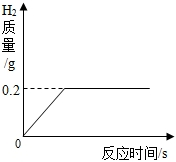 (2013?濱州)將一定質量的金屬鋅投入63.7g稀硫酸中,恰好完全反應,放出氣體的質量與反應時間的關系如圖所示.試求(計算結果精確到0.1%):
(2013?濱州)將一定質量的金屬鋅投入63.7g稀硫酸中,恰好完全反應,放出氣體的質量與反應時間的關系如圖所示.試求(計算結果精確到0.1%):查看答案和解析>>
科目:初中化學 來源: 題型:
 (2008?南寧)將一定質量的金屬鋅投入到63.7 g稀硫酸中,恰好完全反應,放出氣體的質量與反應時間的關系如圖所示.請你據此分析計算:反應結束后所得溶液中溶質的質量分數.
(2008?南寧)將一定質量的金屬鋅投入到63.7 g稀硫酸中,恰好完全反應,放出氣體的質量與反應時間的關系如圖所示.請你據此分析計算:反應結束后所得溶液中溶質的質量分數.查看答案和解析>>
科目:初中化學 來源:2013年初中畢業升學考試(山東濱州卷)化學(解析版) 題型:計算題
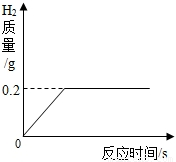
將一定質量的金屬鋅投入63.7g稀硫酸中,恰好完全反應,放出氣體的質量與反應時間的關系如圖所示.試求(計算結果精確到0.1%):

(1)完全反應后生成氫氣的質量為 g
(2)所用硫酸溶液中溶質的質量分數
(3)反應結束后所得溶液的質量.
查看答案和解析>>
科目:初中化學 來源:2013年山東省濱州市中考化學試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com