
分析 碳酸鈣與稀鹽酸反應生成氯化鈣、水和二氧化碳;13g石灰石(主要成分是碳酸鈣)、100g足量的稀鹽酸、燒杯中剩余物質量110.6g均為混合物的質量;由質量守恒定律,燒杯內質量的減少的質量即生成二氧化碳的質量,據此根據反應的化學方程式列式計算出參加反應的碳酸鈣的質量,進而計算出石灰石樣品中含碳酸鈣的純度.
解答 解:(1)根據質量守恒定律,生成二氧化碳的質量為13g+100g-110.6g=4.4g.
(2)設參加反應的碳酸鈣的質量為x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$ x=10g
(3)這種石灰石樣品中含碳酸鈣的純度是$\frac{10g}{13g}×$100%≈76.9%.
答:(1)4.4;(2)此石灰石樣品中碳酸鈣的質量為10g;(3)這種石灰石樣品中含碳酸鈣的純度是76.9%.
點評 本題難度不大,掌握根據化學方程式的計算即可正確解答本題,根據質量守恒定律計算出二氧化碳的質量是正確解答本題的前提和關鍵.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取少量固體放于試管中,滴加足量的稀鹽酸. | 固體逐漸消失,有大量無色氣體產生,得到淺綠色溶液. | 固體中一定含有Fe,一定不含Fe2O3. |
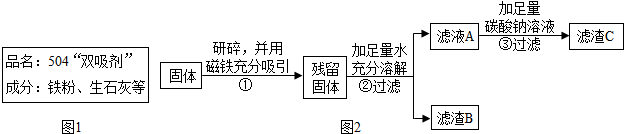
| 實驗操作 | 實驗現象 | 實驗結論 |
| ①取濾渣B于試管中,加入適量稀鹽酸 ②將生成的氣體通入澄清石灰水 | ①固體減少,有氣泡冒出,溶液變為黃色. ②澄清石灰水變渾濁 | 固體中一定含有CaCO3 和Fe2O3 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A | 物質的性質與用途 | C | 安全常識 |
| N2性質穩定-填充食品袋防腐 O2支持燃燒-可作發射火箭燃料 | 進入深洞-用手電筒做燈火試驗 天然氣泄漏-關閉閥門,開窗通風 | ||
| B | 日常生活經驗 | D | 構成物質的基本微粒 |
| 生活中硬水軟化-煮沸 電視機著火-用水撲滅 | 原子-由原子核和核外電子構成 陽離子-質子數>電子數 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com