6.5g不純的鋅粒(只含一種雜質)與足量的稀硫酸反應放出0.21g氫氣,則鋅粒中所含的金屬雜質不可能是( )
A.Cu
B.Al
C.Mg
D.Fe
【答案】
分析:根據鋅與鹽酸反應的化學方程式可以計算出6.5g純鋅能生成0.2g氫氣.由于0.2g<0.21g,說明不純的鋅中所含的雜質能與鹽酸反應且能產生氫氣,而且等質量的鋅和所含雜質相比,雜質與鹽酸反應產生的氫氣多,據此分析解答;
解答:解:設5.6g純鋅與鹽酸反應生成氫氣的質量為x.
Zn+2HCl=ZnCl
2+H
2↑
65 2
6.5g x
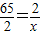
x=0.2g<0.21g
說明等質量的鋅和雜質與鹽酸反應時雜質產生的氫氣多
銅在金屬活動順序表中排在氫的后面,說明銅不能與鹽酸反應,所以不純的鋅不可能混入銅;
由于鋁、鎂、鋅、鐵的相對原子質量由小到大的順序是:鋁<鎂<鐵<鋅,根據經驗公式生成的氫氣量=

可知:等質量的鎂、鐵、鋁與鹽酸反應時產生的氫氣質量都比鋅多,所以都有可能是混入的雜質;
故選A
點評:本題的關鍵是所含雜質要求能與鹽酸反應、能產生氫氣、與鋅的質量相等時比鋅產生的氫氣多.

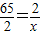
 可知:等質量的鎂、鐵、鋁與鹽酸反應時產生的氫氣質量都比鋅多,所以都有可能是混入的雜質;
可知:等質量的鎂、鐵、鋁與鹽酸反應時產生的氫氣質量都比鋅多,所以都有可能是混入的雜質;
