
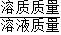 ×100%;加入5gNaOH固體完全溶解后,所得溶液中溶質質量為原溶液中溶質質量與后加入的氫氧化鈉質量之和,溶液質量為原溶液質量與所加入氫氧化鈉質量之和.
×100%;加入5gNaOH固體完全溶解后,所得溶液中溶質質量為原溶液中溶質質量與后加入的氫氧化鈉質量之和,溶液質量為原溶液質量與所加入氫氧化鈉質量之和. ×100%,得出鹽酸的溶質質量分數.
×100%,得出鹽酸的溶質質量分數.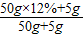 ×100%=20%;
×100%=20%; 解得,X=1.825g,
解得,X=1.825g,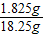 ×100%=10%.
×100%=10%.

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:《第10單元 酸和堿》2011年單元測試卷(羊角山中學)(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com