
 堿式碳酸銅[化學式為Cu2(OH)2CO3,相對分子質量為222]加熱完全分解后得到的黑色固體是什么呢?甲、乙、丙三位同學想通過實驗探究,來確定該黑色固體的組成.
堿式碳酸銅[化學式為Cu2(OH)2CO3,相對分子質量為222]加熱完全分解后得到的黑色固體是什么呢?甲、乙、丙三位同學想通過實驗探究,來確定該黑色固體的組成.| 物 質 | H2SO4 | Na2SO4 | MgSO4 |
| 常溫下的溶解度∕g | 與水以任意比互溶 | 18.0 | 39.0 |
 Cu+CO2↑,所以不可能是二者的混合物,可以排除猜想③;
Cu+CO2↑,所以不可能是二者的混合物,可以排除猜想③;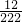 ×22.2g=1.2g≠1.6g,所以不可能是碳,排除了猜想②;
×22.2g=1.2g≠1.6g,所以不可能是碳,排除了猜想②;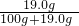 ×100%≈17%,即最大質量分數不會超過17%,而圖中信息為20%,則一定不是硫酸鈉溶液;
×100%≈17%,即最大質量分數不會超過17%,而圖中信息為20%,則一定不是硫酸鈉溶液;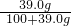 ×100%≈28.06%,即最大質量分數不會超過28.06%,可能是硫酸鎂;
×100%≈28.06%,即最大質量分數不會超過28.06%,可能是硫酸鎂; Cu+CO2↑;
Cu+CO2↑;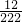 ×22.2g=1.2g≠1.6g;
×22.2g=1.2g≠1.6g;

科目:初中化學 來源: 題型:
 2009年2月法國欲拍賣我圓明園兔首和鼠首兩件文物(如圖).
2009年2月法國欲拍賣我圓明園兔首和鼠首兩件文物(如圖).查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
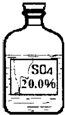
 (1)課外活動小組的同學為了探究實驗室的一種黑色粉末和一瓶標簽破損的無色溶液(如右圖)可能是什么物質,大膽猜想并設計實驗進行驗證,請你參與他們的探究.
(1)課外活動小組的同學為了探究實驗室的一種黑色粉末和一瓶標簽破損的無色溶液(如右圖)可能是什么物質,大膽猜想并設計實驗進行驗證,請你參與他們的探究.| 二氧化錳 |
| 二氧化錳 |
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com