
某不純的鐵5.6g與足量的稀硫酸充分反應,生成0.21g氫氣,則鐵中混有的金屬可能是( )
A.Zn B.Cu C.Mg D.Ag
C
【解析】
試題分析:銅、銀不能和稀硫酸反應;
解:設5.6g鐵與足量的稀硫酸充分反應生成氫氣的質量為X,
Fe+H2SO4═FeSO4+H2↑
56 2
5.6g X
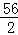 =
=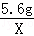
X=0.2g;
解:設5.6g鋅與足量的稀硫酸充分反應生成氫氣的質量為Y,
Zn+H2SO4═ZnSO4+H2↑
65 2
5.6g Y
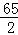 =
=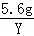
Y=0.17g,
解:設5.6g鎂與足量的稀硫酸充分反應生成氫氣的質量為Z,
Mg+H2SO4═MgSO4+H2↑
24 2
5.6g Z
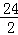 =
=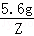
Z=0.47g,
由以上計算可知,當5.6g純鐵與足量稀硫酸反應時能夠生成0.2g氫氣,
當5.6g純鋅與足量稀硫酸反應時能夠生成0.17g氫氣,
當5.6g純鎂與足量稀硫酸反應時能夠生成0.47g氫氣,
由此可知,不純的鐵5.6g中,如果含有鋅,則生成的氫氣小于0.2g,如果含有鎂,則生成的氫氣大于0.2g,
不純的鐵5.6g與足量的稀硫酸充分反應,生成0.21g氫氣,則鐵中混有的金屬可能是鎂.
故選:C.
考點:根據化學反應方程式的計算.
點評:解答本題要注意臨界點,即以5.6g為純鐵時為基礎,計算出生成氫氣的質量,然后再通過計算判斷出雜質是什么物質.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源:2013年四川省達州市中考化學試卷(解析版) 題型:選擇題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com