用“>”、“<”或“=”符號填空.
(1)V1mL水和V2mL酒精混合后溶液的體積 ______(V1+V2) mL;
(2)t℃時,NaCl的溶解度為5g,則t℃時,10g NaCl飽和溶液中NaCl的質量分數 ______5%;
(3)同一溫度下,分別將100g KCl飽和溶液和200g KCl飽和溶液蒸發掉10g水,析出的晶體質量分別為m g和n g,則m ______n;
(4)將5g CuSO4完全溶于95g水中,所得溶液的質量分數 ______5%.
解:(1)由于構成水和酒精的分子間存在間隙,因此,V
1mL水和V
2mL酒精混合后溶液的體積小于(V
1+V
2) mL;
故答案為:<;
(2)t℃時NaCl的溶解度為5g,所以,t℃時,10g NaCl飽和溶液中NaCl的質量分數=
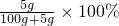
≈4.7%<5%;
故答案為:<;
(3)同一溫度下,分別將100g KCl飽和溶液和200g KCl飽和溶液蒸發掉10g水,由于蒸發掉水的質量相等,因此,析出晶體的質量相等;
故答案為:=;
(4)5g CuSO
4完全溶于95g水中,所得溶液的質量分數=
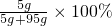
=5%;
故答案為:=.
分析:(1)根據構成物質的微粒間存在間隙,判斷一定體積的酒精溶于一定體積的水中所得溶液的體積的變化;
(2)利用飽和溶液的溶質的質量分數=

,計算t℃時氯化鈉飽和溶液的溶質的質量分數;
(3)飽和溶液蒸發水而析出晶體的質量即該溫度下蒸發掉的水所能溶解溶質的質量;
(4)利用溶液的質量分數=

,計算5g硫酸銅溶于95g水中所得溶液的溶質質量分數.
點評:一定溫度下飽和溶液的溶質的質量分數=

,利用該算法可以方便地解決飽和溶液的溶質質量分數類問題.

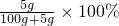 ≈4.7%<5%;
≈4.7%<5%;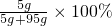 =5%;
=5%; ,計算t℃時氯化鈉飽和溶液的溶質的質量分數;
,計算t℃時氯化鈉飽和溶液的溶質的質量分數; ,計算5g硫酸銅溶于95g水中所得溶液的溶質質量分數.
,計算5g硫酸銅溶于95g水中所得溶液的溶質質量分數. ,利用該算法可以方便地解決飽和溶液的溶質質量分數類問題.
,利用該算法可以方便地解決飽和溶液的溶質質量分數類問題.