某廠生產的純堿中含有少量氯化鈉.取12g該樣品于燒杯中,并滴加稀鹽酸至73g時,氣泡不再冒出,此時稱得燒杯內溶液的總質量為80.6g.請計算:
(1)產生二氧化碳氣體的質量是________g;
(2)樣品中碳酸鈉的質量;
(3)若將反應后所得溶液的溶質質量分數變為20%,需蒸發掉多少克水?
解:(1)二氧化碳的質量=12g+73g-80.6g=4.4g;故答案為4.4;
(2)設 12g樣品中Na
2CO
3的質量為X,反應生成的NaCl的質量為Y.
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 117 44
X Y 4.4g
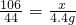
X=10.6g
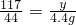
Y=11.7g
設需蒸發水的質量為Z.

×100%=20%
Z=15.1g
答:(2)樣品中Na
2CO
3的質量為10.6g (3)需蒸發掉15.1g水.
分析:(1)燒杯中的物質前后減少的質量為二氧化碳的質量.
(2)根據二氧化碳的質量可求出碳酸鈉的質量.
(3)依據反應方程式可求生成的氯化鈉質量,同時可依據碳酸鈉的質量求出原混合物中氯化鈉的質量,進而依據反應后溶液的質量求出所得溶液的溶質質量分數;
點評:此題是對化學方程式計算的考查,解題的關鍵是找到已知量,此題則是利用反應前后物質質量的變化求出生成二氧化碳的質量,而后根據它的質量求出其它的需要的物質的質量解答即可.

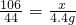
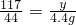
 ×100%=20%
×100%=20%
