

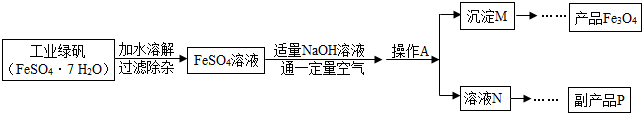
 Fe3O4+4H2O,控制“一定量空氣”的目的是______,沉淀M中Fe(OH)2和Fe(OH)3的最佳質量比為______.
Fe3O4+4H2O,控制“一定量空氣”的目的是______,沉淀M中Fe(OH)2和Fe(OH)3的最佳質量比為______. Fe3O4+4H2O的順利發生,應保持一定比例的Fe(OH)2、Fe(OH)3,所以需要控制通入空氣的量;根據反應的化學方程式Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O的順利發生,應保持一定比例的Fe(OH)2、Fe(OH)3,所以需要控制通入空氣的量;根據反應的化學方程式Fe(OH)2+2Fe(OH)3 Fe3O4+4H2O,沉淀M中Fe(OH)2和Fe(OH)3的最佳質量比即兩物質恰好完全反應時的質量比,此質量比為
Fe3O4+4H2O,沉淀M中Fe(OH)2和Fe(OH)3的最佳質量比即兩物質恰好完全反應時的質量比,此質量比為 Fe3O4+4H2O,因此可判斷出控制空氣質量的意義;根據反應的化學方程,計算反應中兩物質的質量比,即Fe(OH)2和Fe(OH)3的最佳質量比.
Fe3O4+4H2O,因此可判斷出控制空氣質量的意義;根據反應的化學方程,計算反應中兩物質的質量比,即Fe(OH)2和Fe(OH)3的最佳質量比.

 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:

| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com