
 ×100%即可求得氫氧化鈉和所得溶液的中溶質的質量分數.
×100%即可求得氫氧化鈉和所得溶液的中溶質的質量分數.
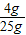 ×100%=16%;由于反應后溶液的質量是25g+24.5g=49.5g,所以反應后溶質的質量分數是
×100%=16%;由于反應后溶液的質量是25g+24.5g=49.5g,所以反應后溶質的質量分數是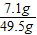 ×100%=14.3%
×100%=14.3%

 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化學 來源:不詳 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com