
【題目】根據如圖中a、b、c三種物質的溶解度曲線,回答下列問題:

(1)P點表示在t1℃時b和c兩物質的溶解度相等,還可以表示______________。
(2)現有等質量的a、b、c三種物質,配成t2℃時的飽和溶液,所得飽和溶液質量的大小關系為_________。
(3)t2℃時,50 g b物質加入到50 g水中充分溶解后,所得溶液的質量為_______。
(4)b中含有少量的a,若要提純b,可采用________結晶的方法。
【答案】t1℃時,b和c的飽和溶液溶質質量分數相等 c>a>b 75g 降溫
【解析】
(1)飽和溶液的質量分數可以用該公式計算:![]() ×100%,P點表示在t1℃時b和c兩物質的溶解度相等,還可以表示t1℃時,b和c的飽和溶液溶質質量分數相等。
×100%,P點表示在t1℃時b和c兩物質的溶解度相等,還可以表示t1℃時,b和c的飽和溶液溶質質量分數相等。
(5)在同一溫度下,對不同的物質,溶解度越大,配制成飽和溶液時所需溶劑的質量越小,最終形成的溶液的質量越小。t2℃時,b物質的溶解度最大,a物質的溶解度次之,c物質的溶解度最小,所以取等質量的a、b、c三種固體物質加水溶解,配成t2℃時的飽和溶液,所得溶液的質量大小關系是:c>a>b。
(3)t2℃時,b物質的溶解度為50g, 50 g水中最多溶解25g的b物質,所得溶液的質量為50 g+25g=75g。
(4)b物質的溶解度受溫度變化影響較大,b中含有少量的a,若要提純b,可采用降溫結晶的方法。


 新非凡教輔沖刺100分系列答案
新非凡教輔沖刺100分系列答案科目:初中化學 來源: 題型:
【題目】結合下列檢驗氫氧化鈉溶液變質的實驗,回答有關問題。
(1)氫氧化鈉溶液露置于空氣中變質的反應可以用化學方程式表示__。
(2)通過實驗檢驗氫氧化鈉溶溶液是否變質;
下列實驗中,可判斷出其是否變質的是_____。
A 樣品+酚酞溶液
B 樣品+過量稀鹽酸
C 樣品+澄清石灰水
D 樣品+硝酸鋇溶液
(3)通過實驗確定氫氧化鈉容易的變質程度:
取20g該氫氧化鈉溶液,加入過量的氯化鈣溶液,共產生沉淀5g,據此計算,該溶液中碳酸鈉的質最分數為___。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在一密閉容器內加入甲、乙、丙、丁四種物質,測得反應前后各物質的質量如下表所示:
物質 | 甲 | 乙 | 丙 | 丁 |
反應前質量/g | 50 | 1 | 1 | 23 |
反應后質量/g | 2 | 45 | 28 | x |
下列說法錯誤的是( )
A.x等于0
B.該反應可能為置換反應
C.該反應中甲與乙質量的變化比為48: 23
D.該反應遵循質量守恒定律
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】二氧化氯(ClO2)具有很強的殺菌能力,是國際上公認的安全、無毒的綠色消毒劑。生產二氧化氯可用亞氯酸鹽——氯氣法:![]() 。下列說法不正確的是
。下列說法不正確的是
A.二氧化氯是一種化合物
B.二氧化氯中氯元素的化合價為+4
C.生成67.5kg二氧化氯,需要氯氣的質量至少為71kg
D.二氧化氯可應用于飲用水、食品加工、公共環境等的消毒
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】石灰石高溫煅燒獲得的生石灰是煉鋼生產中的主要堿性造渣材料,其活性度好壞對冶煉過程有重要影響。
(提出問題)哪些因素可能影響生石灰的活性度?
(查閱資料)生石灰活性度體現了生石灰與其他物質的反應能力,是表征生石灰水化反應速度的一個指標。生產中常用的檢測標準定義為:在足夠時間內,用中和生石灰消化時產生的Ca(OH)2所消耗的鹽酸的體積數(單位為mL)表示。
(進行實驗)
實驗1:相同條件下,煅燒不同石灰石,測生石灰的活性度。
產地 | 石灰石 | 生石灰 | |
外觀 | CaO含量/% | 活性度/mL | |
A地 | 灰白色 | 94.89 | 391 |
B地 | 灰白色帶少量紅棕色 | 89.97 | 375 |
實驗2:取某石灰石試樣,在電爐內進行煅燒,燒成后測定生石灰的活性度。
時間/min | 各煅燒溫度下的生石灰活性度/mL | |||||
1050℃ | 1100℃ | 1150℃ | 1200℃ | 1250℃ | 1300℃ | |
12 | 790 | 836 | 868 | 808 | 454 | 412 |
16 | 793 | 856 | 871 | 845 | 556 | 530 |
20 | 795 | 863 | 873 | 864 | 617 | 623 |
實驗3:煅燒溫度1050℃時,加NaCl和不加NaCl,比較煅燒石灰石的分解率(分解率影響生石灰活性度)。
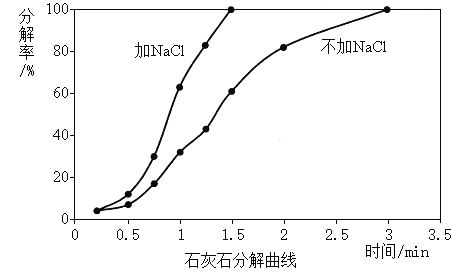
(解釋與結論)
(1)實驗1的目的是___________。
(2)能證明最佳煅燒溫度為1100~1200℃的證據是__________。
(3)實驗3的結論是_________。
(反思與評價)
(4)寫出石灰石高溫分解生成生石灰和另一種氧化物的化學方程式_________。
(5)除以上研究的可能影響生石灰活性度的因素外,你認為還可以研究的其他因素有_______(寫出一條即可)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】廢舊金屬可回收利用,某化學興趣小組用合金廢料(含Fe、Cu和Al)制取FeSO4溶液和回收金屬銅,實驗流程如圖所示(部分生成物已略去)。已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
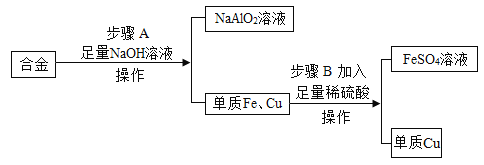
(1)單質鐵的金屬活動性比銅_______(填“強”或“弱”)。
(2)操作Ⅱ用到的玻璃儀器有燒杯、漏斗和_________(填儀器名稱)。
(3)步驟B發生反應的化學方程式為_____________,該反應屬于基本反應類型中的________反應。
(4)鋁制品在空氣中耐腐蝕的原因是________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】堿式氧化鎳(化學式為:NiOOH)可用作鎳氫電池的正極材料。工業上以某廢液(主要溶質為:硫酸鎳,其化學式為:NiSO4,另外還含有一些其他雜質。)為原料生產NiOOH 的步驟如下:
步驟 I:向廢液中加入 Na2CO3 溶液生成沉淀,過濾,洗滌,得到固體 NiCO3。
步驟 II:向固體 NiCO3 中加入稀硫酸,固體溶解,得到硫酸鎳溶液。
步驟 III:調節硫酸鎳溶液的 pH,可將硫酸鎳轉化為氫氧化鎳沉淀(化學式為:Ni(OH)2), 過濾并洗滌沉淀。
步驟 IV:將氫氧化鎳沉淀置于空氣中加熱,生成堿式氧化鎳(化學式為:NiOOH)。 請回答以下問題:
(1)NiOOH 中 Ni 的化合價為:_____。
(2)寫出向廢液中加入 Na2CO3 溶液生成 NiCO3 沉淀的化學方程式_____。
(3)步驟 I 和步驟 II 的作用是:_____。
(4)步驟 IV中生成了堿式氧化鎳和水,請寫出步驟 IV中發生反應的化學方程式:______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】為了探究金屬與酸反應的規律,某實驗小組進行了如圖實驗,取等質量的鐵片、鎂片、鋅片,分別與等體積、等濃度的稀鹽酸反應,用溫度傳感器測得反應溫度變化曲線如圖所示。下列有關說法錯誤的是( )
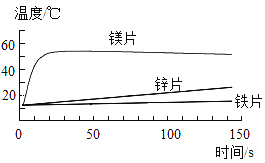
A.溫度升高的原因是金屬與酸反應放出熱量
B.50s時鐵反應放出的熱量最少
C.由圖象可得金屬性強弱的順序Mg>Zn>Fe
D.反應結束三種金屬產生氣體質量一定相等
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某校初三學生去西樵山春游,帶回了幾塊石灰石樣品。為了檢測樣品中碳酸鈣的含量,甲、乙、丙、丁四位同學用質量分數相同的鹽酸與樣品充分反應來進行測定![]() 假設樣品中的雜質不溶于水,且不與鹽酸反應
假設樣品中的雜質不溶于水,且不與鹽酸反應![]() ,測得數據如表:
,測得數據如表:
甲 | 乙 | 丙 | 丁 | |
均勻研磨后的石灰石樣品質量 |
|
|
|
|
鹽酸的質量 |
|
|
|
|
剩余固體的質量 |
|
|
|
|
試問答:
(1)![]() 樣品與
樣品與![]() 鹽酸充分反應后,鹽酸是否有剩余______
鹽酸充分反應后,鹽酸是否有剩余______ ![]() 填“是”或“否”
填“是”或“否”![]() ;樣品中碳酸鈣的質量分數是______。
;樣品中碳酸鈣的質量分數是______。
(2)計算所用鹽酸的質量分數![]() 寫出計算過程
寫出計算過程![]()
(3)畫出![]() 樣品與
樣品與![]() 鹽酸混合后產生二氧化碳的質量與鹽酸的關系圖。
鹽酸混合后產生二氧化碳的質量與鹽酸的關系圖。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com