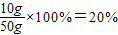某同學為了測定一瓶用于制作“葉脈書簽”的氫氧化鈉溶液的溶質質量分數,進行如下實驗:先在燒杯中加入50g待測的氫氧化鈉溶液,滴入幾滴酚酞溶液,再用滴管慢慢滴入25%的硫酸溶液,邊滴邊攪拌至溶液顏色恰好變成無色為止,共消耗硫酸溶液49g.(氫氧化鈉與硫酸反應生成硫酸鈉和水)
請你計算:
(1)49g25%的硫酸溶液中溶質的質量.
(2)待測氫氧化鈉溶液的溶質質量分數.
【答案】
分析:(1)利用溶質的質量等于溶液的質量乘以溶質的質量分數解決.
(2)利用硫酸的質量通過方程式求氫氧化鈉的質量,再利用溶質質量分數的計算要求求溶質的質量分數.
解答:解;(1)溶質的質量等于溶液的質量乘以溶質的質量分數.
則硫酸的質量是49g×25%=12.25g
答:49g25%的硫酸溶液中溶質的質量是12.25g
根據酸的質量求氫氧化鈉的質量,再利用氫氧化鈉溶液的質量求溶液的溶質質量分數.
解:設反應消耗NaOH的質量為x
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
2×40 98
x 12.25g
x=
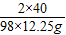
=10g
待測氫氧化鈉溶液的溶質質量分數為:
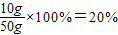
答:待測氫氧化鈉溶液的溶質質量分數時20%
點評:此題是對溶液進行的綜合計算,涉及到溶質質量的計算、方程式的計算,解決此題對學生計算能力的提高有一定好處.

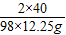 =10g
=10g