
 可以知道制的同質量的氫氣所需要的金屬的質量關系,依據判斷消耗的酸的質量,據此分析解答即可;
可以知道制的同質量的氫氣所需要的金屬的質量關系,依據判斷消耗的酸的質量,據此分析解答即可;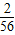 =
=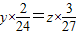 ,所以可得參加反應的金屬質量比是28:12:9;
,所以可得參加反應的金屬質量比是28:12:9;

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
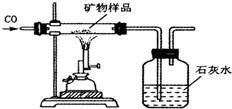 已知某金屬X有下列相關信息:①它的主要礦物的化學成分是X2O3;②它主要通過熱還原法冶煉而成;③它的年產量位于金屬之首.
已知某金屬X有下列相關信息:①它的主要礦物的化學成分是X2O3;②它主要通過熱還原法冶煉而成;③它的年產量位于金屬之首.查看答案和解析>>
科目:初中化學 來源: 題型:多選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com