
請根據下圖所示的實驗過程和提供的數據計算
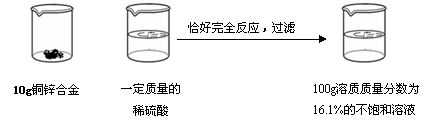 |
+
(1)生成氫氣 g;
(2)合金中銅的質量分數是 ;
(3)所用稀硫酸的溶質質量分數是多少?(寫出計算過程,計算結果保留到0 .1%)
.1%)
 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
取10g碳酸鈣與溶質質量分數為10%的稀鹽酸反應,恰好完全反應時得到溶液的質量為ag;另取10g碳酸鈣高溫完全分解后,取生成的CaO與上述同濃度的稀鹽酸反應,恰好完全反應時得到溶液的質量為bg,則a與b的大小關系為( )
A..a=b B.a>b C.a<b D.不能確定
查看答案和解析>>
科目:初中化學 來源: 題型:
某同學在實驗室發現一瓶由碳酸鈉和氯化鈉組成的混合溶液.為了測定該混合溶液中碳酸鈉的質量分數,該同學設計了如下實驗:取該混合溶液50g,向其中逐滴加入稀鹽酸,當加入鹽酸的質量為15g、30g、45g、60g時,生成氣體的質量見下表(氣體的溶解度忽略不計).
| 第Ⅰ組 | 第Ⅱ組 | 第Ⅲ組 | 第Ⅳ組 | |
| 稀鹽酸的質量/g | 15 | 30 | 45 | 60 |
| 生成氣體的質量/g | 1.8 | n | 4.4 | 4.4 |
(1)第Ⅱ組數據n為 _________ g.
(2)混合溶液中碳酸鈉的質量分數是多少?(寫出計算過程,結果精確至0.1%)
查看答案和解析>>
科目:初中化學 來源: 題型:
菱鎂礦的主要成分是MgCO3,為了分析某菱鎂礦中鎂元素的含量,某學習小組進行了實驗研究,取10g菱鎂礦,逐漸加入未知濃度的H2SO4溶液,生成的氣體全部用NaOH溶液吸收,NaOH溶液增加的質量記錄如下表:
| 加入H2SO4溶液的質量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的質量/g | 2.2 | 4.4 | 4.4 | 4.4 |
說明:菱鎂礦中的雜質不溶于水,不與酸發生反應。
(1)10g菱鎂礦與H2SO4溶液完全反應,生成CO2的質量為 。
(2)計算該菱鎂礦中鎂元素的質量分數。(寫出計算過程)
(3)該實驗研究中所用H2SO4溶液的溶質的質量分數是 。
(4)為避免溶液排放對環境影響,某同學對上述反應后溶液進行了過濾,并在濾液中加入了1.71%的Ba(OH)2溶液。請你畫出加入Ba(OH)2溶液的質量與產生沉淀的質量的關系圖。(在答題卡的坐標中作圖,并標出曲線折點的坐標)
查看答案和解析>>
科目:初中化學 來源: 題型:
鈣是維持人體正常功能所必須的元素,有時需要服用補鈣滿足人體需求。下圖分別為兩種補鈣劑說明書的一部分。

請根據圖示中的信息回答下列問題:
(1)鈣是人體必須的常量元素,每日要攝取足量的鈣,才能避免 (填字母序號);
A.佝僂病或骨質疏松 B.貧血癥 C.甲狀腺腫大
(2)葡萄糖酸鈣(C12H22O14Ca)的化學式量是 ;
(3)碳酸鈣(化學式為CaCO3)中鈣元素的質量分數為 ;
(4)每片金鈣爾奇中含碳酸鈣的質量為  mg;
mg;
(5)按照金鈣爾奇說明書每日的補鈣量,若該服用葡萄糖酸鈣片,一日3次,一次應服用幾片? 。
查看答案和解析>>
科目:初中化學 來源: 題型:
向154.7 g一定質量分數的稀硫酸溶液中放入10.0 g粗鋅(含有不溶于稀硫酸的雜質),恰好完全反應,共收集到標準狀況下的氫氣2.24 L。(鋅的相對原子質量為65;標準狀況下氫氣的密度約為0.09 g/L)
計算:(均保留1位小數)
(1)反應產生氫氣的質量。
(2)反應結束后,過濾,濾渣的質量。
(3)反應后所得溶液的溶質質量分數。
查看答案和解析>>
科目:初中化學 來源: 題型:
氣體的制備是化學實驗基本技能之一。現用如下裝置進行化學實驗,試回答下列問題:
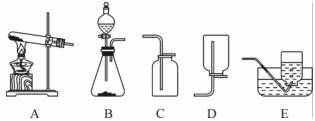
(1)實驗室利用加熱高錳酸鉀的方法能制得氧氣,則發生裝置應選用______(填字母);
(2)實驗室利用B裝置通過復分解反應制得的氣體是______,要制取一瓶該氣體,所選裝置的連接順序是______(填字母);
(3)證明集氣瓶中充滿(2)中所制氣體的方法是________________________________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
根據圖中的信息判斷,下列說法正確的是

 A.氯原子的中子數是17
A.氯原子的中子數是17
B.氯原子核外有2個電子層
C.當x=8時,該微粒是陽離子
D.在化學變化中,氯原子易得到電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com