
| A. | 稀硫酸一加入立即有氣泡產生 | |
| B. | 所得溶液中的溶質為H2SO4和ZnSO4 | |
| C. | 反應后生成ZnSO432.2g | |
| D. | 14.6g表面氧化的鋅片中含鋅元素質量為6.5g |
分析 分析題中所發生的變化可知,反應放出氫氣造成反應前后物質總質量不相等,因此,利用質量守恒先計算出恰好完全反應時所放出氫氣的質量;然后根據反應放出氫氣的質量計算反應的鋅和硫酸的質量及生成硫酸鋅的質量;接下來由鋅片質量與鋅質量差求得氧化鋅,由氧化鋅計算反應生成的硫酸鋅和消耗的酸,據此分析解答即可.
解答 解:
A、稀硫酸一加入,先與氧化鋅反應,氧化鋅被消耗完,鋅再與稀硫酸反應生成氫氣,所以稀硫酸一加入不能立即有氣泡產生,故錯誤;
根據質量守恒定律,反應生成氫氣的質量=14.6g+100g-114.4g=0.2g
設鋅片中單質鋅的質量為x,反應生成硫酸鋅的質量為y,反應的硫酸的質量是z
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x z y 0.2g
$\frac{65}{x}=\frac{98}{z}=\frac{161}{y}=\frac{2}{0.2g}$
x=6.5g y=16.1g z=9.8g
鋅片中的氧化鋅的質量=14.6g-6.5g=8.1g
設鋅片中氧化鋅與硫酸完全反應生成硫酸鋅的質量為w,反應的硫酸的質量為n
ZnO+H2SO4═ZnSO4+H2O
81 98 161
8.1g n w
$\frac{81}{8.1g}=\frac{98}{n}=\frac{161}{w}$
w=16.1g n=9.8g
B、原稀H2SO4中溶質的質量為100g×19.6%=19.6g,消耗硫酸的質量為9.8g+9.8g=19.6g,稀硫酸沒有剩余,所得溶液中的溶質為ZnSO4,故錯誤;
C、反應后生成ZnSO4的質量=16.1g+16.1g=32.1g,故正確;
D、14.6g表面氧化的鋅片中含鋅元素質量為6.5g+8.1g×$\frac{65}{81}$=13g,故錯誤.
答案:C
點評 解答本題時需要注意到鋅片氧化后的氧化鋅也能與硫酸反應,且生成硫酸鋅.


科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
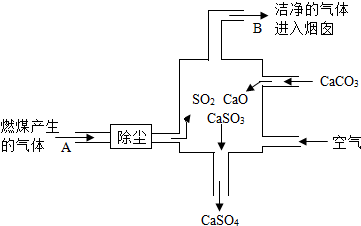
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 物質 | 雜質 | 除去雜質的方法 |
| A | CuSO4溶液 | 稀H2SO4 | 加入足量氧化銅粉末充分反應后過濾 |
| B | NaNO3溶液 | NaCl溶液 | 適量的硝酸銀溶液 |
| C | Cu粉 | Fe粉 | 用磁鐵吸出 |
| D | NaOH溶液 | Na2CO3溶液 | 過量的氯化鈣溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
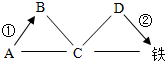 A、B、C、D分別為氧化鐵、鹽酸、氫氧化鈉、碳酸鈉中的一種,它們之間的反應或轉化關系如圖所示(部分物質和反應條件已略去),其中“→”表示物質間的轉化關系,“-”表示物質間可以相互反應.
A、B、C、D分別為氧化鐵、鹽酸、氫氧化鈉、碳酸鈉中的一種,它們之間的反應或轉化關系如圖所示(部分物質和反應條件已略去),其中“→”表示物質間的轉化關系,“-”表示物質間可以相互反應.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com