
 已知氫氧化鋁是一種不溶于水的白色沉淀,能與稀鹽酸反應,也能與過量的氫氧化鈉溶液反應,氫氧化鋁與氫氧化鈉溶液反應的化學方程式為:Al(OH)3+NaOH═NaAlO2+2H2O.生成的偏酸鈉(NaAlO3)可溶于水(但Mg(OH)2固體不溶于NaOH溶液.現有含AlCl3和MgCl2的混合溶液50g,向溶液中逐滴加入溶質質量分數為10%的NaOH溶液,生成沉淀質量與加入NaOH溶液質量關系如圖所示:
已知氫氧化鋁是一種不溶于水的白色沉淀,能與稀鹽酸反應,也能與過量的氫氧化鈉溶液反應,氫氧化鋁與氫氧化鈉溶液反應的化學方程式為:Al(OH)3+NaOH═NaAlO2+2H2O.生成的偏酸鈉(NaAlO3)可溶于水(但Mg(OH)2固體不溶于NaOH溶液.現有含AlCl3和MgCl2的混合溶液50g,向溶液中逐滴加入溶質質量分數為10%的NaOH溶液,生成沉淀質量與加入NaOH溶液質量關系如圖所示:分析 (1)根據氯化鋁和氫氧化鈉溶液首先反應生成氫氧化鋁沉淀和氯化鈉,然后過量的氫氧化鈉溶液繼續和氫氧化鋁沉淀反應生成偏鋁酸鈉和水,而氯化鎂和氫氧化鈉溶液反應生成氫氧化鎂沉淀和氯化鈉進行解答;
(2)根據題意可知,當沉淀的質量最大時,氯化鋁和氯化鎂恰好與氫氧化鈉反應生成氫氧化鋁沉淀和氫氧化鎂沉淀,而沉淀的質量減少,說明氫氧化鋁又和氫氧化鈉反應進行解答;
(3)根據氯化鎂消耗氫氧化鈉的質量求出原混合溶液中MgCl2的質量,進而求出原混合溶液中MgCl2的質量分數即可.
解答 解:(1)氯化鋁和氫氧化鈉溶液首先反應生成氫氧化鋁沉淀和氯化鈉,然后過量的氫氧化鈉溶液繼續和氫氧化鋁沉淀反應生成偏鋁酸鈉和水,而氯化鎂和氫氧化鈉溶液反應生成氫氧化鎂沉淀和氯化鈉,所以當加入NaOH溶液質量為120g時,氫氧化鈉恰好與氫氧化鋁反應生成偏鋁酸鈉和水,故溶液中的溶質有NaAlO2、NaCl; 故填:NaAlO2、NaCl;
(2)消耗氫氧化鋁需要氫氧化鈉的質量M1=(120g-100g)10%=2g
設生成氫氧化鋁沉淀質量為a
NaOH+Al(OH)3=NaAlO2+2H2O
40 78
2g a
$\frac{40}{2g}=\frac{78}{a}$
a=3.9g
設原有氯化鋁的質量為b,消耗氯化鋁需要氫氧化鈉的質量c
3NaOH+AlCl3=3NaCl+Al(OH)3↓
120 133.5 78
c b 3.9g
$\frac{120}{c}=\frac{133.5}{b}=\frac{78}{3.9g}$
b=6.675g
c=6g
(3)消耗氯化鎂需要氫氧化鈉的質量M2=(100g-6g/10%)10%=4g
設原有氯化鎂的質量為d
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 95
4g d
$\frac{80}{4g}=\frac{95}p9vv5xb5$
d=4.75g
原混合溶液中MgCl2的質量分數=$\frac{4.75g}{50g}$×100%=9.5%
答:(2)原混合溶液中AlCl3的質量為6.675g.
(3)原混合溶液中MgCl2的質量分數為9.5%.
點評 本題主要考查學生對化學方程式的計算能力.學生需正確書寫出化學方程式,然后根據化學方程式找出比例關系,列出比例式,并正確分析各物質之間的關系,才能正確答題.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | ①②正確 | B. | 只有②③正確 | C. | 只有②正確 | D. | ①②③④均正確 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:填空題
 如圖是某品牌牙膏包裝盒上說明書的部分內容.
如圖是某品牌牙膏包裝盒上說明書的部分內容.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
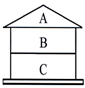 同學們以蓋房子的方式總結出了如下物質間的關系.A、B、C均為純凈物,且上、下相鄰的物質之間均可發生反應.回答下列問題:
同學們以蓋房子的方式總結出了如下物質間的關系.A、B、C均為純凈物,且上、下相鄰的物質之間均可發生反應.回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com