4.6g某物質在空氣中完全燃燒生成8.8g二氧化碳和5.4g水(只有這兩種產物),則關于這種物質的組成描述正確的是( )
A.該物質一定含有碳元素和氫元素,可能含有氧元素
B.該物質一定含有碳元素、氫元素和氧元素
C.該物質中碳元素與氫元素的質量比為6:1
D.該物質的分子中碳原子與氫原子的個數比為1:3
【答案】
分析:4.6g某物質在空氣中完全燃燒生成8.8g二氧化碳和5.4g水,根據燃燒的規律,生成的8.8g二氧化碳中的碳元素和5.4g水中氫元素均來自于4.6g的可燃物,利用碳、氫元素的質量及可燃物的質量,可完成對描述的判斷.
解答:解:8.8g二氧化碳中碳元素的質量=8.8g×

×100%=2.4g;5.4g水中氫元素的質量=5.4g×

×100%=0.6g;
碳、氫元素質量和=2.4g+0.6g=3g,小于可燃物的質量4.6g,因此可燃物中除碳、氫元素外還應含有氧元素;
可燃物中碳、氫元素質量比=2.4g:0.6g=4:1,可燃物的分子中碳原子與氫原子的個數比=
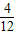
:

=1:3;
故選BD.
點評:可燃物完全燃燒時,可燃物中的碳元素全部生成二氧化碳、可燃物中的氫元素全部生成水.

 ×100%=2.4g;5.4g水中氫元素的質量=5.4g×
×100%=2.4g;5.4g水中氫元素的質量=5.4g× ×100%=0.6g;
×100%=0.6g;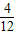 :
: =1:3;
=1:3;

 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案