
分析 (1)碳酸鈣與鹽酸反應放出二氧化碳而使反應后質量減小,利用質量守恒定律可計算放出二氧化碳的質量;根據反應的化學方程式,由放出二氧化碳的質量計算蛋殼中所含碳酸鈣的質量;
(2)根據反應的化學方程式,由放出二氧化碳的質量計算蛋殼中所含氯化鈣的質量.然后利用物質的總質量減去雜質的質量求出溶液的質量,從而求出所得溶液中溶質的質量分數.
解答 解:根據質量守恒定律,生成二氧化碳的質量為80g+30g-101.2g=8.8g
設30g雞蛋殼中碳酸鈣的質量為x,生成氯化鈣的質量為y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 8.8g
$\frac{100}{x}$=$\frac{111}{y}$=$\frac{44}{8.8g}$
x=20g
y=22.2g
所得溶液中溶質的質量分數=$\frac{22.2g}{101.2g-(30g-20g)}$×100%≈24.3%.
故答案為:(1)30g雞蛋殼中碳酸鈣的質量為20g;
(2)所得溶液中溶質的質量分數為24.3%.
點評 利用質量守恒定律求出反應放出二氧化碳的質量,是進行后面計算的基礎,體現出運用知識分析問題的能力.


 金牌課堂練系列答案
金牌課堂練系列答案 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
 碳和部分碳的化合物間轉化關系如圖所示
碳和部分碳的化合物間轉化關系如圖所示查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
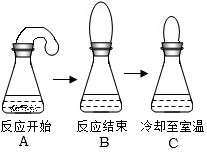 小明同學做了一個趣味實驗,他把氣球中的鎂屑加入到盛有稀鹽酸的錐形瓶中,整個實驗過程如圖所示(實驗裝置的氣密性良好).他關于本實驗的下列說法中不正確的是( )
小明同學做了一個趣味實驗,他把氣球中的鎂屑加入到盛有稀鹽酸的錐形瓶中,整個實驗過程如圖所示(實驗裝置的氣密性良好).他關于本實驗的下列說法中不正確的是( )| A. | 本實驗能說明溫度降低時,分子間間隔變小 | |
| B. | 本實驗能說明與稀鹽酸反應時,鎂屑比鎂條更快 | |
| C. | 本實驗能說明鎂與稀鹽酸反應有熱量放出 | |
| D. | 本實驗能說明鎂與稀鹽酸反應時,有氣體放出 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com