
某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品。
(一)有關資料
原料巖鹽水主要是含NaCl,此外還含有較多Na2SO4,以及少量CaCl2和MgCl2。
上述幾種物質在不同溫度時的溶解度數據如下表:
|
溫度/℃ |
0 |
10 |
20 |
30 |
40 |
|
|
溶 解 度 /g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
|
Na2SO4 |
4.5 |
9.6 |
20.2 |
40.8 |
48.4 |
|
|
CaCl2 |
59.5 |
65.0 |
74.5 |
100 |
116 |
|
|
MgCl2 |
52.9 |
53.8 |
54.8 |
56.0 |
58.0 |
(1)10℃時,飽和Na2SO4溶液中溶質的質量分數是 (精確到0.1 %)。
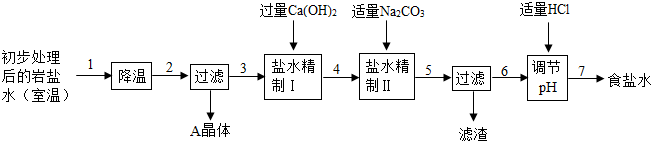
(二)生產工藝
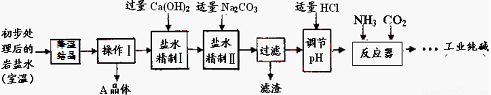
經上述處理后得到主產品:工業純堿,副產品:A晶體。
(2)“降溫”的目的是析出副產品“A晶體”,A的化學式是 ;
(3)反應器中的反應為:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。再將NaHCO3晶體轉移出來后,加熱所得固體即為工業純堿。在整個生產工藝中沒有涉及到的基本反應類型是 ,可重復利用的是 (水除外,只需一種);
(4)在反應器中總是先通氨氣,后通二氧化碳,原因是 。
(三)工業純堿中雜質的判斷:
(5)已知:NH4Cl NH3↑+HCl↑
實驗步驟:①取一定質量的純堿樣品,經多次充分加熱后再稱重,發現質量無變化;
②另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
由上述實驗可確定純堿樣品含有雜質 (寫化學式)。
(四)含量測定
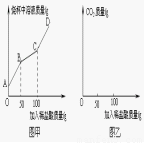
(6)稱取純堿樣品21.3g于燒杯中,加入適量水將其溶解, 然后逐滴加入溶質質量分數為14.6%的稀鹽酸并不斷用玻璃棒攪拌。先發生反應:Na2CO3+HCl=NaHCO3+ NaCl;后發生反應:NaHCO3+HCl= NaCl+H2O+CO2↑。在上述過程中燒杯中溶液質量與加入稀鹽酸質量的關系如圖甲所示(不考慮CO2的溶解),請你根據圖甲提供的信息計算檢測過程中產生CO2的質量 。
(7)請通過計算并結合左表判斷此純堿樣品等級為 品。
(1)8.8%
(2)Na2SO4
(3)置換反應 CO2或NaCl
(4)因為氨氣溶解度大,形成堿性環境便于二氧化碳溶解(可降低要求,如只答第一句)
(5)NaCl
(6)8.8g
(7)99.5% 優等品
【解析】
試題分析:(1)10℃時,飽和Na2SO4溶液的溶解度為9.6g,也就是說在此溫度下100g純水中最多溶解9.6g Na2SO4,質量分數為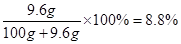 ;(2)根據圖示可知,A為硫酸鈉;(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl是個總反應,涉及到化合反應和復分解反應,碳酸氫鈉受熱分解的反應屬于分解反應,沒有涉及到的反應類型是置換反應;(4)二氧化碳在水中的溶解度較小,氨氣在水中的溶解度較大,先通氨氣可以使水呈堿性,有助于增大二氧化碳的溶解,從而增大了產量;(5)加入稀硝酸和硝酸銀能產生白色沉淀,說明有氯離子,可確定純堿樣品含有雜質氯化鈉;(6)根據題意,反應分為兩步進行,由圖可知,鹽酸加入質量在50g到100g間時溶液溶質的質量分數變化減小,說明這個過程發生的反應為NaHCO3+HCl= NaCl+H2O+CO2↑,設生成的二氧化碳質量為
;(2)根據圖示可知,A為硫酸鈉;(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl是個總反應,涉及到化合反應和復分解反應,碳酸氫鈉受熱分解的反應屬于分解反應,沒有涉及到的反應類型是置換反應;(4)二氧化碳在水中的溶解度較小,氨氣在水中的溶解度較大,先通氨氣可以使水呈堿性,有助于增大二氧化碳的溶解,從而增大了產量;(5)加入稀硝酸和硝酸銀能產生白色沉淀,說明有氯離子,可確定純堿樣品含有雜質氯化鈉;(6)根據題意,反應分為兩步進行,由圖可知,鹽酸加入質量在50g到100g間時溶液溶質的質量分數變化減小,說明這個過程發生的反應為NaHCO3+HCl= NaCl+H2O+CO2↑,設生成的二氧化碳質量為 g,總反應方程式為
g,總反應方程式為
Na2CO3+2HCl= 2NaCl+H2O+CO2↑
73 44
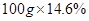

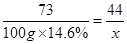 ,解得
,解得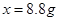 ,所以生成二氧化碳的質量為8.8g;
,所以生成二氧化碳的質量為8.8g;
(7)設消耗碳酸鈉的質量為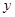 g,有
g,有
Na2CO3+2HCl= 2NaCl+H2O+CO2↑
106 73
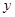
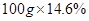
 ,解得
,解得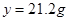
碳酸鈉的質量分數為: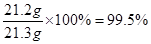
對比表格的標準可知,為優等品。
考點:化學方程式的計算
點評:本題較為綜合,是集實驗探究和化學方程式計算于一體的題目,題目較為冗長,屬于較難的題目,在中考中常作為壓軸題出現。


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 某制堿廠以巖鹽水為主要原料生產純堿(碳酸鈉)和其他副產品.
某制堿廠以巖鹽水為主要原料生產純堿(碳酸鈉)和其他副產品.| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 | 氯化鈉 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 解 | 硫酸鈉 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 |
| 度 | 氯化鈣 | 59.5 | 65.0 | 74.5 | 100 | 116 |
| /g | 氯化鎂 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 |
| 所加鹽酸的次數 | 第一次 | 第二次 | 第三次 | 第四次 |
| 鹽酸的質量 | 25 | 25 | 25 | 25 |
| 燒杯及所盛物質總質量 | 180.3 | 202.6 | 226.4 | 251.4 |
查看答案和解析>>
科目:初中化學 來源: 題型:
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化鈉 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 硫酸鈉 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| 氯化鈣 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| 氯化鎂 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
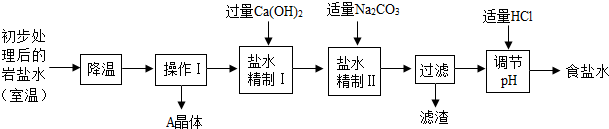
 某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品.
某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品.| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |

| 工業純堿標準(Na 2CO3%≥) | ||
| 優等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化學 來源: 題型:
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |

| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com