
 某制堿廠以巖鹽水為主要原料生產純堿(碳酸鈉)和其他副產品.
某制堿廠以巖鹽水為主要原料生產純堿(碳酸鈉)和其他副產品.| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 | 氯化鈉 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 解 | 硫酸鈉 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 |
| 度 | 氯化鈣 | 59.5 | 65.0 | 74.5 | 100 | 116 |
| /g | 氯化鎂 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 |
| 所加鹽酸的次數 | 第一次 | 第二次 | 第三次 | 第四次 |
| 鹽酸的質量 | 25 | 25 | 25 | 25 |
| 燒杯及所盛物質總質量 | 180.3 | 202.6 | 226.4 | 251.4 |
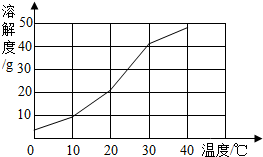 解:(一)溶解度曲線如右圖:
解:(一)溶解度曲線如右圖:| 106 |
| x |
| 44 |
| 6.6g |
| 15.9g |
| 18.0g |


科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源: 題型:
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化鈉 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 硫酸鈉 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| 氯化鈣 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| 氯化鎂 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
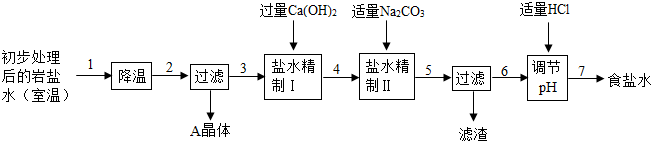
 某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品.
某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品.| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |

| 工業純堿標準(Na 2CO3%≥) | ||
| 優等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化學 來源: 題型:
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |

| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com