
| 實驗序號 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的質量(克) | 20 | 20 | 20 | 20 |
| 充分反映后剩余固體的質量(克) | 17.2 | 14.4 | 12.00 | m |
分析 (1)分析反應及實驗數據:根據金屬活動性,合金中只有鐵可以與硫酸反應;根據質量守恒定律,由第1次實驗數據可知,每加入20g稀硫酸完全反應可放出20g-17.2g=2.8g,據此分析,第3次加入20g稀硫酸時放出氫氣質量14.4g-12.0g=2.4g<2.8g,可判斷此時合金中金屬鐵已完全反應,所以,第4次加入的稀硫酸不再放出氫氣;
(2)使用金屬鐵完全反應時剩余固體銅的質量,計算樣品中金屬鐵的質量,利用鐵的質量與樣品的質量比計算銅鐵合金樣品中鋅的質量分數;
(3)使用第1次實驗數據,由生成氫氣的質量,根據反應的化學方程式,計算參加反應硫酸的質量,利用硫酸的質量與所加稀硫酸的質量比計算所用稀硫酸中硫酸的質量分數.
解答 解:(1)根據質量守恒定律,由第1次實驗數據可知,每加入20g稀硫酸完全反應可放出20g-17.2g=2.8g,據此分析,第3次加入20g稀硫酸時放出氫氣質量14.4g-12.0g=2.4g<2.8g,可判斷此時合金中金屬鐵已完全反應,所以,第4次加入的稀硫酸不再消耗金屬而不再放出氫氣,因此充分反應后剩余固體的質量仍為12g;
(2)銅鐵合金的樣品中鐵的質量分數=$\frac{20g-12g}{20g}$×100%=40%;
(3)設所用稀硫酸中硫酸的質量分數為x,
H2SO4 +Fe═FeSO4+H2↑
98 56
20g×x 20g-17.2g=2.8g
$\frac{98}{56}=\frac{20g×x}{2.8g}$ 解得:x=24.5%
故答案為:(1)12;(2)40%;(3)所用稀硫酸中硫酸的質量分數是24.5%
點評 計算所用稀硫酸的溶質質量分數時,注意選取稀硫酸完全反應時的實驗數據即前三次實驗的數據進行計算.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
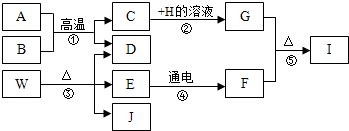
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 選擇自行車和公交車作為出行工具 | |
| B. | 讓衣服自然晾干,節約用紙,不使用一次性塑料袋 | |
| C. | 將廢紙、塑料瓶等收集起來,一次性焚燒 | |
| D. | 拒絕使用一次性木筷,用電子賀卡代替紙制賀卡 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
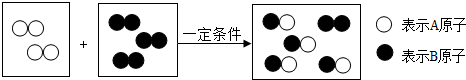
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 該反應一定屬于置換反應或復分解反應 | |
| B. | A、B的相對分子質量之和,一定等于C、D的相對分子質量之和 | |
| C. | A為酸,則C、D一定有一種物質為鹽 | |
| D. | 若C為水,則A、B中至少有一種物質為酸或堿 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 用一桶水洗車 | |
| B. | 盡可能步行、乘坐公交車,少開私家車 | |
| C. | 用竹籃代替塑料袋 | |
| D. | 為了方便,經常使用一次性木筷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com