
| 學 生 物 質 質 量 | 甲 | 乙 | 丙 | 丁 |
| 所取固體樣品的質量(g) | 30 | 25 | 20 | 20 |
| 加入硫酸溶液的質量(g) | 100 | 100 | 100 | 120 |
| 反應后剩余固體的質量(g) | 22 | 17 | 12 | 12 |
分析 根據金屬活動性銅活動性處于H之后,不能與稀硫酸反應,因此銅和氧化銅的混合物加入稀硫酸,只有氧化銅與硫酸發生反應;分析表中數據找出恰好完全反應的實驗數據進行計算.
解答 解:由表中數據對比分析:丙中反應前固體是20g,反應后固體是12g,故反應的氧化銅質量為8g,由丁和丙對比,固體混合物相同,酸由100g增加到120g,反應掉的氧化銅仍為8g,說明20g混合物中只含8g氧化銅.由乙丙對比固體混合物質量不同,酸相同,而反應掉的氧化銅相同都是8g,說明25g混合物中的氧化銅沒有全部反應,即100g稀硫酸能與20g混合物中的8g氧化銅恰好完全反應.所以甲乙兩同學硫酸量不足,丙同學恰好完全反應,丁同學酸剩余.
(1)丙同學的實驗中,混合物為20g,剩余固體為12g,所以樣品中有8g的氧化銅參加了反應;
混合物中氧化銅的質量分數=$\frac{8g}{20g}$×100%=40%
(2)設參加反應的硫酸質量為X
CuO+H2SO4═CuSO4+H2O
80 98
8g X
$\frac{80}{8g}=\frac{98}{X}$
X=9.8g
硫酸的質量分數:$\frac{9.8g}{100g}$×100%=9.8%
(3)四位同學中,甲乙兩位同學所取的硫酸溶液質量不足,丁同學的硫酸過量,故丙是完全反應的,故填:丙;
(4)設生成硫酸銅的質量為x
CuO+H2SO4═CuSO4+H2O
80 160
8g x
$\frac{80}{160}=\frac{8g}{x}$
x
=16g
丁同學實驗反應所得硫酸銅溶液的質量分數為:$\frac{16g}{8g+120g}×100%$=12.5%
答:(1)樣品中氧化銅的質量分數為40%;
(2)硫酸溶液中溶質的質量分數為9.8%;
(3)丙;
(3)丁同學實驗反應所得硫酸銅溶液的質量分數為12.5%.
點評 本題主要考查含雜質物質的化學方程式計算和溶質質量分數的計算,難度較大.


 亮點激活精編提優100分大試卷系列答案
亮點激活精編提優100分大試卷系列答案科目:初中化學 來源: 題型:選擇題
| A. | 乙炔+氧氣$\stackrel{點燃}{→}$二氧化碳+水 | |
| B. | 紅磷+氧氣$\stackrel{點燃}{→}$五氧化二磷 | |
| C. | 高錳酸鉀$\stackrel{加熱}{→}$錳酸鉀+二氧化錳+氧氣 | |
| D. | 分離液態空氣得氮氣和氧氣 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 常見鐵的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 顏色、狀態 | 黑色粉末 | 紅棕色粉末 | 黑色晶體 |
| 能否被磁鐵吸引 | 否 | 否 | 能 |
| 實驗操作 | 實驗現象及結論 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
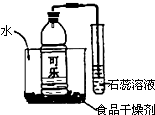 如圖是某化學興趣小組的同學設計的一個趣味實驗,其中食品干燥劑的主要成分為生石灰,雜質不考慮.請回答:
如圖是某化學興趣小組的同學設計的一個趣味實驗,其中食品干燥劑的主要成分為生石灰,雜質不考慮.請回答:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com