
 2016年4月16日厄瓜多爾發生7.8級強震,20日,中國政府派遣多支救援隊到達厄首都基多,展開救助,同行攜帶大量救援物資,如消毐液、大米和帳篷等.
2016年4月16日厄瓜多爾發生7.8級強震,20日,中國政府派遣多支救援隊到達厄首都基多,展開救助,同行攜帶大量救援物資,如消毐液、大米和帳篷等.分析 (1)由質量守恒定律:反應前后,原子種類、數目均不變,據此由反應的化學方程式推斷反應物X的化學式.根據在化合物中正負化合價代數和為零,結合NaClO的化學式進行解答;
(2)根據四環素的化學式C22H24N2O8,根據化合物中元素質量分數大小的比較方法來分析.
解答 解:(1)由質量守恒定律:反應前后,原子種類、數目均不變,由反應的化學方程式2NaOH+X═NaClO+NaCl+H2O,反應前鈉、氧、氫原子個數分別為2、2、2,反應后的生成物中鈉、氧、氫、氯原子個數分別為2、2、2、2,根據反應前后原子種類、數目不變,則每個X分子由2個氯原子構成,則物質X的化學式為Cl2.
鈉元素顯+1價,氧元素顯-2價,設氯元素的化合價是x,根據在化合物中正負化合價代數和為零,可得:(+1)+x+(-2)=0,則x=+1價.
(2)根據四環素的C22H24N2O8,在四環素中,C元素和H元素的原子個數比為11:12,而四環素中各元素的質量比是C:H:N:O=(12×22):(1×24):(14×2):(16×8)=264:24:28:128,由此可見其中碳元素的質量分數最大.
故答案為:
(1)Cl2;+1;(2)11:12; C.
點評 本題難度不大,利用化學反應前后原子守恒來確定物質的化學式、化合物中正負化合價代數和為零是正確解答此類題的關鍵.


科目:初中化學 來源: 題型:解答題
| 實驗操作 | 實驗現象 | 實驗結論及分析 | |
| Ⅰ.取少量該固體粉末于燒杯中,加入足量的水溶解、過濾 | 粉末部分溶解,得到白色濾渣和無色濾液 | 濾渣中一定含有碳酸鈣 | |
| Ⅱ.向濾液中滴加無色酚酞試液 | 溶液變紅 | 濾液中可能含有堿性物質(填“酸性”“堿性”或“中性”) | |
| Ⅲ.向Ⅱ中所得溶液滴加足量稀鹽酸 | 有氣泡生成 | 原固體粉末中一定含有Na2CO3 | |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
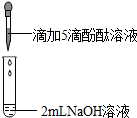 實驗室有兩瓶常溫下的飽和溶液,已知它們是氫氧化鈉溶液和石灰水,為了區分并驗證它們的性質,雅汶和心靜等同學進行了如下探究實驗.
實驗室有兩瓶常溫下的飽和溶液,已知它們是氫氧化鈉溶液和石灰水,為了區分并驗證它們的性質,雅汶和心靜等同學進行了如下探究實驗.| 實驗 | 實驗操作 | 實驗現象 | |
| 1 | 向盛有2mL Na2CO3溶液的試管中滴加5滴0.5%的酚酞溶液 | 溶液變紅 | |
| 2 | 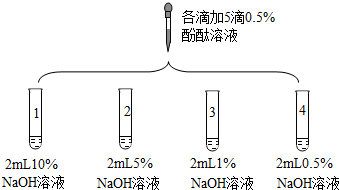 | 1號試管0.1min紅色褪去 2號試管5min紅色褪去 3號試管30min紅色明顯變淺 4號試管120min紅色無明顯變化 | |
| 3 | 取3支試管,各加入2mL水,… | 酚酞溶液 | 渾濁程度 |
| 5% | 大量渾濁物 | ||
| 2% | 少量渾濁物 | ||
| 0.5% | 無渾濁物 | ||
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
 春節期間,小穎陪媽媽去醫院打點滴,發現護士往輸液管上放了一個紙包,經詢問得知它是輸液恒溫貼,可以溫暖輸入人體中的液體.小穎對包里的東西能產生熱量感到很神奇,于是,他向護士要了一只輸液恒溫貼,帶回來進行了如下探究.撕開真空包裝封口,剪開內包裝袋,倒出其中的粉末,發現呈黑色.
春節期間,小穎陪媽媽去醫院打點滴,發現護士往輸液管上放了一個紙包,經詢問得知它是輸液恒溫貼,可以溫暖輸入人體中的液體.小穎對包里的東西能產生熱量感到很神奇,于是,他向護士要了一只輸液恒溫貼,帶回來進行了如下探究.撕開真空包裝封口,剪開內包裝袋,倒出其中的粉末,發現呈黑色.| 實驗 編號 | 實驗操作 | 實驗現象 |
| ① | 取少量黑色粉末于試管中,加足量稀硫酸 | 固體部分溶解,有氣泡產生,溶液變為淺綠色 |
| ② | 將實驗①試管中的物質過濾,向濾液中加入足量鐵粉 | 有氣泡產生,無紅色物質析出 |
| ③ | 取實驗②的濾渣灼燒,將內壁涂有澄清石灰水的小燒杯罩在上方 | 澄清石灰水變渾濁 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
| 俗名 | 蘇打 純堿 | 小蘇打 |
| 化學式 | Na2CO3 | NaHCO3 |
| 構成微粒 | Na+ CO32- | Na+ HCO3- |
| 溶解度(常溫) | 21.5克 | 9.6克 |
| 兩者的轉化 | Na2CO3+CO2+H2O═2NaHCO3 | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2+H2O |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
| 實驗 | 試管1 | 試管2 |
| 操作 | 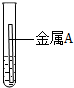 | 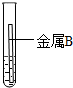 |
| 現象 | 金屬表面產生氣泡較慢 | 金屬表面產生氣泡較快 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. |  比較Zn和Fe的金屬活動性強弱 | B. | 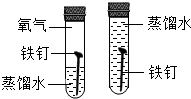 探究鐵釘生銹時O2是否參與反應 | ||
| C. |  比較紅磷和白磷的著火點 | D. |  測定空氣中O2的含量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com