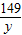某同學(xué)在實驗室中用老師提供的氯酸鉀和二氧化錳的混合物8.0g為原料制取氧氣,加熱一段時間后,剩余固體的質(zhì)量為5.6g.問:
(1)反應(yīng)產(chǎn)生的氧氣的質(zhì)量是多少?
(2)分解的氯酸鉀的質(zhì)量是多少?
(3)根據(jù)以上信息,能不能確定原混合物中二氧化錳的質(zhì)量?請說明理由.
【答案】
分析:(1)根據(jù)質(zhì)量守恒定律,生成氧氣的質(zhì)量=反應(yīng)前物質(zhì)質(zhì)量總和-反應(yīng)后物質(zhì)質(zhì)量總和;
(2)利用氯酸鉀受熱分解的化學(xué)方程式和生成氧氣的質(zhì)量,列出比例式,就可計算出參與反應(yīng)的氯酸鉀質(zhì)量;
(3)由于該題中沒有信息表明氯酸鉀是否完全分解,所以可先假設(shè)氯酸鉀完全分解而后進行驗證從而判斷是否能夠確定二氧化錳的質(zhì)量;
解答:解:(1)根據(jù)質(zhì)量守恒定律,生成氧氣的質(zhì)量=8.0g-5.6g=2.4g;
(2)設(shè)參與反應(yīng)的氯酸鉀質(zhì)量為x,生成氯化鉀的質(zhì)量是y
2KClO
3
2KCl+3O
2↑
245 149 96
x y 2.4g
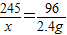
=
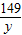
x=6.125g y=3.725g
(3)由于該題中沒有信息表明氯酸鉀是否完全分解,所以假設(shè)氯酸鉀完全反應(yīng),則可知原混合物中二氧化錳的質(zhì)量為8.0g-6.125g=1.875g,由于二氧化錳在化學(xué)反應(yīng)前后質(zhì)量不變,所以剩余的固體應(yīng)該為3.725g+1.875g=5.6,所以假設(shè)正確,因此可以確定二氧化錳的質(zhì)量;
答:(1)反應(yīng)產(chǎn)生的氧氣的質(zhì)量是2.4g;
(2)分解的氯酸鉀的質(zhì)量是6.1g;
(3)能,因為該題中沒有信息表明加熱一段時間后氯酸鉀是否完全分解,所以假設(shè)氯酸鉀完全反應(yīng),則可知原混合物中二氧化錳的質(zhì)量為8.0g-6.125g=1.875g,由于二氧化錳在化學(xué)反應(yīng)前后質(zhì)量不變,所以剩余的固體應(yīng)該為3.725g+1.875g=5.6g,所以假設(shè)正確,因此可以確定二氧化錳的質(zhì)量.
點評:本題主要考查學(xué)生利用化學(xué)方程式和質(zhì)量守恒定律解答問題的能力.解題的關(guān)鍵是根據(jù)質(zhì)量守恒定律求出生成氧氣的質(zhì)量;

 2KCl+3O2↑
2KCl+3O2↑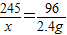 =
=