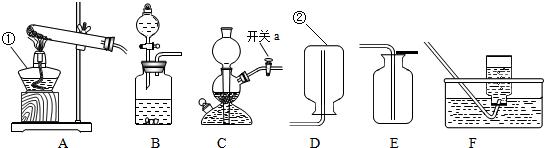
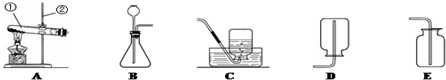
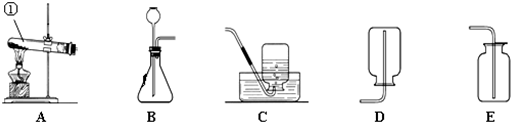
解:(1)給儀器加熱的儀器是酒精燈,收集氣體的儀器是集氣瓶;
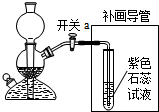
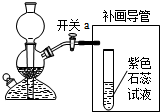
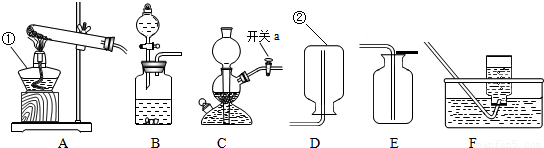
(2)實驗過程中關閉開關a,會形成密閉系統而氣體仍然產生,卻出不來,容器內氣體增多,導致壓強增大;
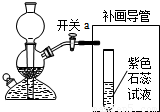
(3)補畫導管需要將二氧化碳與水反應,所以要將導管通入溶液中,二氧化碳與水反應生成碳酸,碳酸屬于酸能使紫色石蕊試液變紅;
(4)反應物的狀態是固體和液體,不需要加熱,如果固體與固體反應制取氣體需要加熱,雙氧水和二氧化錳是固體和液體不需要加熱;收集方法的選擇是根據:難溶于水或不易溶于水用排水法收集,密度比空氣大用向上排空氣法收集,密度比空氣小用向下排空氣法收集,由于氧氣不易溶于水,密度比空氣大,所以用排水法收集或向上排空氣法收集;
(5)解設過氧化氫的物質的量為X
2H
2O
2
2H
2O+O
2↑
2 1
X 0.5mol
根據:

解得X=1mol
過氧化氫的質量為:1mol×34g/mol=34g
故答案為:
(1)①酒精燈;②集氣瓶;
(2)反應還在繼續,容器內氣體增多;
(3)

;有氣泡冒出,試液變紅;
(4)BE或BF;
(5)1mol;34.
分析:(1)熟記常見儀器的名稱;
(2)根據關閉開關a會形成密閉系統來考慮;
(3)補畫導管需要將二氧化碳與水反應,所以要將導管通入溶液中,根據二氧化碳與水反應的產物考慮溶液的變色情況;
(4)根據發生裝置的選擇方法和收集裝置的選取方法來選取裝置圖;
(5)根據分子數之比等于物質的量之比求出物質的量,根據物質的量與質量的關系算出質量.
點評:通過回答本題知道了常見儀器的名稱,發生裝置的選擇方法和收集裝置的選取方法,了解了關于物質的量和質量的計算方法.



 2H2O+O2↑
2H2O+O2↑  解得X=1mol
解得X=1mol ;有氣泡冒出,試液變紅;
;有氣泡冒出,試液變紅;

 名校課堂系列答案
名校課堂系列答案