
 如圖是“XXX”鈣片商品標簽圖.
如圖是“XXX”鈣片商品標簽圖.分析 (1)根據碳酸鈣的化學式,利用相對分子質量等于各元素相對原子質量的和即可求得碳酸鈣的相對分子質量;
(2)鈣元素都在碳酸鈣中了,用碳酸鈣的質量×鈣元素在碳酸鈣中的質量分數,求出鈣元素的質量.
(3)根據物質質量守恒,計算出生成的二氧化碳的質量,再根據化學方程式,得出各物質之間的質量比,列出比例式,即可求出反應掉HCl的質量,再根據溶質質量分數公式,即可求得稀鹽酸中溶質的質量分數;
根據方程式的還可以計算出4片鈣片中碳酸鈣的質量,進而計算出一片鈣片中碳酸鈣的質量,再與標簽做比較即可.
解答 解:(1)碳酸鈣的化學式為:CaCO3,故碳酸鈣的相對分子質量為:40+12+16×3=100;
碳酸鈣(CaCO3)中鈣元素的質量分數為:$\frac{40}{40+12+16×3}$×100%=40%,
則每片中至少含鈣元素的質量為1.24g×40%=0.496g.
故答案為:100;0.496.
(2)解:①根據質量守恒定律可知,生成CO2的質量為:40g+4×2.5g-47.8g=2.2g
②設參加反應的CaCO3和HCl的質量分別為x,y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 2.2g
$\frac{100}{x}=\frac{73}{y}=\frac{44}{2.2g}$
解得x=5g;y=3.65g
則稀鹽酸中溶質的質量分數為:$\frac{3.65g}{40g}$×100%=9.13%.
③每片含CaCO3的質量為:$\frac{5g}{4}$=1.25g>1.24g,故鈣片中碳酸鈣的含量標注準確.
答:生成二氧化碳的質量是2.2g,稀鹽酸中溶質的質量分數為9.13%,通過計算含量標注屬實.
點評 本題主要考查學生運用化學式以及化學方程式進行進行計算的能力.解決本題的關鍵是計算生成二氧化碳的質量.


科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
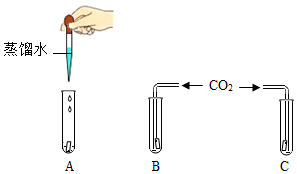 為證明CO2能與水反應,設計了如圖所示的實驗,圖中A、B、C分別為用石蕊溶液染成的紫色干燥的濾紙,分析回答問題
為證明CO2能與水反應,設計了如圖所示的實驗,圖中A、B、C分別為用石蕊溶液染成的紫色干燥的濾紙,分析回答問題查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 實驗方案 | 取少量燒杯中溶液 | 實驗現象 | 實驗結論 |
| 方案一 | 加入Na2CO3溶液 | 有氣泡產生 | 溶液中有H2SO4 |
| 方案二 | 滴加紫色石蕊溶液 | 溶液變紅 | 溶液中有H2SO4 |
| 方案三 | 加入BaC12溶液 | 有白色沉淀生成 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

| 實驗內容 | 預計現象 | 預計結論 |
| 取少量廢液缸中上層清液于試管中,加入過量氯化鈣溶液,靜置. | 小方的猜想正確. |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
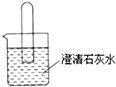 如圖所示,將一個充滿二氧化碳的試管倒立在盛有澄清石灰水的燒杯中,
如圖所示,將一個充滿二氧化碳的試管倒立在盛有澄清石灰水的燒杯中,查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com