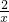50g19.6% 的稀硫酸與適量的鎂恰好完全反應.(友情提示:該反應的化學方程式為 Mg+H2SO4=MgSO4+H2↑ )
試通過計算回答:
(1)充分反應后,所得溶液中的溶質是______(填化學式).
(2)充分反應后生成氫氣的質量是多少?
解:(1)鎂與硫酸反應生成了硫酸鎂和氫氣,可以據此判斷反應后所得溶液中的溶質為硫酸鎂,其化學式為:MgSO
4;
(2)設產生氫氣的質量為x
Mg+H
2SO
4═MgSO
4+H
2↑
98 2
50g×19.6% x
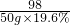
=
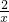
解得:x=0.2g
答:產生氫氣0.2g.
故答案為:(1)MgSO
4;
(2)0.2g.
分析:(1)鎂與硫酸反應生成了硫酸鎂和氫氣,可以據此判斷反應后所得溶液中的溶質為硫酸鎂,可以據此解答該題.
(2)由硫酸的質量結合鎂與稀硫酸反應的化學方程式可以計算出生成氫氣的質量.,而后依據稀硫酸的質量可求出硫酸的溶質質量分數.
點評:本題主要考查有關化學方程式的計算.本題比較簡單,由反應物的質量可以根據化學方程式直接計算相關物質的質量.

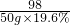 =
=