
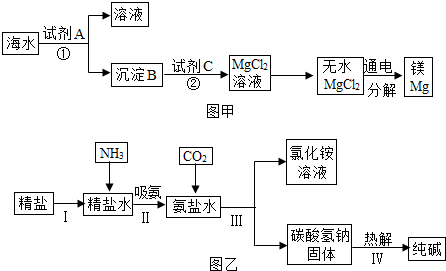
分析 (1)根據蒸餾的原理回答;
(2)根據反應中的反應物、生成物的特點進行分析;
(3)根據沉淀B與試劑C發生的是中和反應,則沉淀B是氫氧化鎂,氯化鎂在通電的條件下生成鎂和氯氣進行分析;
(4)根據氯化鈉的溶解度受溫度影響不大的特點回答前一空;根據SO42-、Ca2+、Mg2+等易轉化為沉淀而被除去,以及根據不能產生新雜質的要求排序,前面加入的過量溶液應用后加入的溶液除去,最后加入適量的溶液;
(5)根據二氧化碳和氨氣的溶解性不同解答,碳酸氫鈉在加熱的條件下生成碳酸鈉、水和二氧化碳進行分析.
解答 解:(1)從海水中獲取淡水,是除去水中可溶性雜質的過程,水蒸發可變成水蒸氣,然后再凝結可形成水,而海水中溶解的可溶性雜質只會留在母液中,所以可用蒸餾法;
(2)工業上常用“吹出法”制溴,主要化學原理是2NaBr+C12=2NaCl+Br2,其反應類型是置換反應;
(3)沉淀B與試劑C發生的是中和反應,則沉淀B是氫氧化鎂,化學式為Mg(OH)2,氯化鎂在通電的條件下生成鎂和氯氣,化學方程式為:MgCl2$\frac{\underline{\;通電\;}}{\;}$Mg+Cl2↑;
(4)氯化鈉的溶解度受溫度影響不大,改變溫度不易析出,所以用蒸發的方法;SO42-、Ca2+、Mg2+等分別與BaCl2溶液、Na2CO3溶液、NaOH溶液反應生成沉淀,可再通過過濾除去,Na2CO3溶液能除去過量的BaCl2溶液,鹽酸能除去過量的Na2CO3溶液和NaOH溶液,所以應先加,BaCl2溶液再加Na2CO3溶液,最后加入鹽酸,所以正確順序為①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥);
(5)因為二氧化碳在水中溶解度比較小,直接向海水中通二氧化碳,溶解量太小;如果先通氨氣,因為氨氣極易溶于水,且溶于水后溶液呈堿性,有利于二氧化碳的溶解;碳酸氫鈉在加熱的條件下生成碳酸鈉、水和二氧化碳,化學方程式為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故答案為:(1)蒸餾法;
(2)置換反應;
(3)Mg(OH)2,MgCl2$\frac{\underline{\;通電\;}}{\;}$Mg+Cl2↑;
(4)蒸發結晶,1325746(或1532746或1352746);
(5)氨氣溶于水后形成堿性溶液,更容易吸收二氧化碳;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
點評 化學來源于生產、生活,又服務于生產、生活,氨堿工業是初中化學重要的應用之一,是考查重點,常涉及化學方程式的書寫,二氧化碳和氨氣通入的順序及原因,反應時析出碳酸氫鈉的原因與物質溶解度的關系等重點內容.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:解答題
 生活中處處有化學,請用相關的知識回答下列問題:
生活中處處有化學,請用相關的知識回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
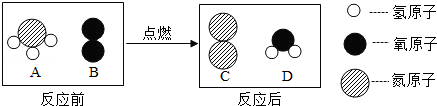
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 物 質 | 雜 質 | 除雜試劑 | 提 純 方 法 | |
| A | CO2 | CO | O2 | 點燃 |
| B | KCl | MnO2 | 水 | 溶解、過濾、蒸發 |
| C | CaO | CaCO3 | 稀鹽酸 | 溶解、過濾 |
| D | KNO3 | NaCl | H2O | 溶解、蒸發、過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 加入NaOH溶液的體積/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 燒杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
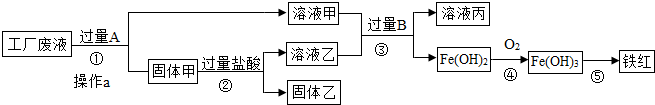
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com