
| A. | 若樣品不含任何雜質,則m<1.8 | |
| B. | 若m=1.8,則樣品中一定含有雜質A,可能含有固體KOH | |
| C. | 若m>1.8,則樣品中一定含有固體KOH,可能含有雜質A | |
| D. | 若樣品中不含A,則鹽酸的溶質質量分數可能為4% |
分析 假設5.6g全部為氫氧化鈉,然后根據氫氧化鈉和鹽酸反應的化學方程式計算出能夠生成的水的質量及消耗的鹽酸中溶質的質量,然后結合題給的選項進行分析并作出判斷.
解答 解:假設5.6g全部為氫氧化鈉,則設生成水的質量為x,鹽酸溶質的質量為y
NaOH+HCl═NaCl+H2O
40 36.5 18
5.6g y x
$\frac{40}{5.6g}=\frac{36.5}{y}=\frac{18}{x}$
解得:x=2.52g y=5.11g
假設樣品全部為氫氧化鉀,則設生成水的質量為z
KOH+HCl═KCl+H2O
56 18
5.6g z
$\frac{56}{5.6g}=\frac{18}{z}$
解得:z=1.8g
故:
A、根據上述計算可以知道若樣品不含任何雜質生成水的質量為2.52g,故A錯誤;
B、因為全部為氫氧化鈉生成水的質量為2.56g,所以若生成水的質量為1.8g,則說明在樣品中一定含有雜質,當然其中也可能含有氫氧化鉀,故B正確;
C、根據B的分析可以知道,若生成水的質量為1.8g,則說明在樣品中一定含有雜質,但不可能只有含有氫氧化鉀,因為,根據我們的計算可以知道,單獨的氫氧化鈉反應生成水的質量大于1.8g,而單獨的氫氧化鉀反應生成水的質量等于1.8g,所以如果樣品中的雜質只含有氫氧化鉀的話,生成的水的質量必然大于1.8g,故C錯誤;
D、若樣品中不含有雜質,則根據與氫氧化鈉反應的稀鹽酸的質量可以計算出鹽酸溶質的質量分數為:
$\frac{5.11g}{100g}$×100%=5.11%,考慮到氫氧化鉀的存在也會消耗一定質量的稀鹽酸,所以可以判斷稀鹽酸的質量分數必然小于7.3%,故D錯誤;
故選B
點評 把握住記錄數據中在發生著變化的數據,分析數據變化的原因或變化的規律,這是分析實驗數據的一種常用方法,也是這類題的解題關鍵.


 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:初中化學 來源: 題型:填空題
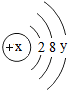 ,當y等于0時,該粒子帶3個單位的正電荷,則該粒子符號是Al3+,寫出該粒子形成氧化物的化學式Al2O3.
,當y等于0時,該粒子帶3個單位的正電荷,則該粒子符號是Al3+,寫出該粒子形成氧化物的化學式Al2O3.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 是氧化物 | B. | C、O元素質量比為55:24 | ||
| C. | 由三種非金屬和一種金屬組成 | D. | 質量分數最大的元素是碳元素 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
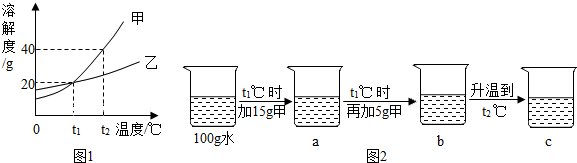
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
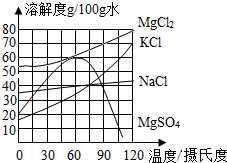 食鹽在生產和生活中具有廣泛的用途,是一種重要的資源,海水中儲量很豐富,通過晾曬海水可以得到粗鹽和鹵水.如圖所示為NaCl及鹵水主要成分的溶解度曲線圖.
食鹽在生產和生活中具有廣泛的用途,是一種重要的資源,海水中儲量很豐富,通過晾曬海水可以得到粗鹽和鹵水.如圖所示為NaCl及鹵水主要成分的溶解度曲線圖.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 實 驗 目 的 | 實 驗 方 案 |
| A | 分離NaCl和CaCO3的混合物 | 溶解、過濾、蒸發濾液 |
| B | 比較金屬鎂和鋁的活動性 | 將鎂條和鋁條分別放入等質量、等濃度的鹽酸中 |
| C | 除去CO2中的CO | 將混合氣體通過足量的灼熱氧化銅 |
| D | 證明NaOH溶液是否變質 | 取樣,加入少量稀鹽酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 茶氨酸屬于有機高分子化合物 | |
| B. | 一個茶氨酸分子中含有一個氮分子 | |
| C. | 茶氨酸中氧元素的質量分數最大 | |
| D. | 茶氨酸中碳元素與氫元素的質量比為6:1 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 偏向左邊 | B. | 偏向右邊 | C. | 仍指零處 | D. | 無法確定 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
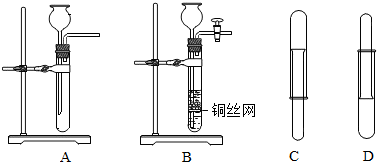
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com