
 ,
, ,
,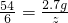
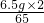 =0.2g,y=
=0.2g,y= =0.1g,z=
=0.1g,z= =0.3g,
=0.3g,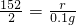
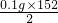 =7.6g.
=7.6g.

 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:新教材完全解讀 九年級化學 (上冊) 人教版 人教版 題型:038
某一含銅6.4 g、鋅6.5 g、鐵5.6 g、鋁2.7 g的金屬粉末混合物,與一定質量的稀硫酸反應.待反應停止后,經實驗測得尚有9.2 g固體沒有反應掉,通過計算回答:
(1)可得到氫氣多少升?(已知該條件下2 g氫氣占體積22.4 L)
(2)生成硫酸亞鐵多少克?
查看答案和解析>>
科目:初中化學 來源:專項題 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com