考點:有機物與無機物的區別,證明碳酸鹽,二氧化碳的化學性質,二氧化碳對環境的影響,溶液的酸堿性測定,碳單質的物理性質及用途,碳的化學性質,反應類型的判定,書寫化學方程式、文字表達式、電離方程式,化石燃料及其綜合利用,幾種常用的滅火器
專題:碳單質與含碳化合物的性質與用途
分析:(1)根據有機物的定義和物質的組成分析回答;
(2)根據化石燃料的種類、成分及減少二氧化碳排放的措施分析回答.
(3)根據碳海綿的特點分析判斷;
(4)根據滅火的原理和二氧化碳的性質分析判斷;
(5)①分析步驟1發生的反應,寫出反應的化學方程式;
②根據碳酸鈣與鹽酸的反應分析回答;
③根據上述反應的特點分析判斷;
④根據CO2和H2在一定條件下可合成甲酸(HCOOH)的反應及甲酸的性質分析判斷.
(6)①根據碳、二氧化碳以及一氧化碳的轉化分析;
②根據反應的特點分析反應的類型;
③根據鎂與二氧化碳的反應寫出反應的方程式.
解答:解:(1)乙醇是含碳的化合物,屬于有機物;碳酸鈣和二氧化碳雖然含有碳元素,具有無機化合物的特點,常把它們看做無機物.
(2)化石燃料主要包括煤、石油和天然氣,他們都含有碳元素,其中天然氣的主要成分是甲烷,化學式是:CH
4.含碳物質的燃燒會導致過多的二氧化碳排放,加劇了“溫室效應”,減少二氧化碳排放的措施有很多例如:節約用紙、不使用一次性筷子等.
(3)由于碳海綿具有多孔結構,彈性好,具有吸附性;它對石油有很強的吸附能力,將吸入的石油擠出后仍可恢復原狀,可處理海上石油泄漏,并且可重復利用.
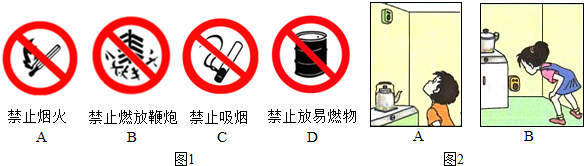
(4)液態二氧化碳滅火器可用于撲救檔案資料室發生的火災,是由于二氧化碳可覆蓋在燃燒物表面,隔絕空氣從而達到滅火的目的,同時具有二氧化碳氣化后不會污染檔案資料的特點;著火點是可燃物的屬性,一般不能改變.
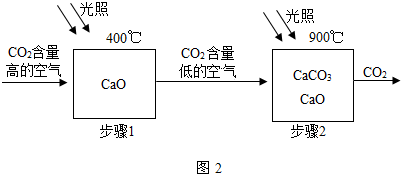
(5)①由題意可知,步驟1發生的反應是在400°C時,二氧化碳與氧化鈣反應生成了碳酸鈣,反應的化學方程式是:CaO+CO
2CaCO
3;
②由于碳酸鈣與鹽酸的反應生成了二氧化碳氣體.為判斷碳酸鈣是否完全分解,可取少量固體于試管中,滴加過量稀鹽酸溶液,若觀察到試管內有氣泡,則分解不完全.
③根據上述反應的特點可知,碳酸鈣高溫分解生成了氧化鈣,氧化鈣與二氧化碳反應又生成了碳酸鈣,在上述反應中原料易得且可循環利用,且充分利用太陽能.由于夜間沒有太陽能,不能全天候使用
④一分子的CO
2和一分子的H
2在一定條件下可合成一分子的甲酸(HCOOH),因此此反應中CO
2與H
2的分子個數比為1:1;酸性物質能夠使紫色的石蕊試液變成紅色,不能使酚酞試液變色,用pH試紙測定的pH會<7;
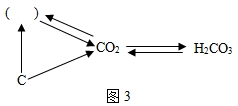
(6)①碳充分燃燒生成二氧化碳,不充分燃燒生成一氧化碳,一氧化碳燃燒能生成二氧化碳,所以,括號內一種含有碳元素物質的化學式是CO;
②由H
2CO
3→CO
2的反應可知,是由一種物質生成了兩種物質,屬于分解反應;
③由題意可知,CO
2常用于滅火,但鎂著火不能用 CO
2滅火,原因是它們能發生反應生成另一種氧化物和單質.根據質量守恒定律可知,氧化物是氧化鎂,單質是碳.反應的方程式是:2Mg+CO
22MgO+C.
故答為:(1)B;(2)石油 CH
4.節約用紙;(3)A、B、C;(4)A、B;(5)①CaO+CO
2CaCO
3;②鹽酸;有氣泡產生;③ab;④1:1;bc;(6)①CO ②分解 ③2Mg+CO
22MgO+C.
點評:本題內容豐富,涉及的知識點較多,但難度不大.掌握常見的碳的單質、碳以及其化合物的轉化、化學方程式的書寫方法等是解答本題的關鍵.




 發散思維新課堂系列答案
發散思維新課堂系列答案 已知金屬鋁具有自我保護能力,這是因為鋁會在其表面產生一層致密的氧化膜(主要成分為氧化鋁).家庭使用的鋁壺底部會產生一層水垢(主要成分為碳酸鈣和氫氧化鎂).某同學用稀鹽酸長時間浸泡以除去水垢,結果鋁壺底部也被腐蝕.請寫出該過程發生反應的化學方程式.
已知金屬鋁具有自我保護能力,這是因為鋁會在其表面產生一層致密的氧化膜(主要成分為氧化鋁).家庭使用的鋁壺底部會產生一層水垢(主要成分為碳酸鈣和氫氧化鎂).某同學用稀鹽酸長時間浸泡以除去水垢,結果鋁壺底部也被腐蝕.請寫出該過程發生反應的化學方程式.