
分析 (1)根據質量守恒定律計算生成氫氣的質量;
(2)根據生成氫氣的質量,依據化學方程式進行計算.
解答 解:(1)生成氫氣的質量為:20g+50g-69.8g=0.2g
設參加反應的鋅的質量為x,生成硫酸鋅質量為y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
$\frac{65}{x}$=$\frac{161}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=16.1g
樣品中鋅的質量分數為:$\frac{6.5g}{20g}$×100%=32.5%;
恰好完全反應后所得溶液中溶質的質量分數為:$\frac{16.1g}{50g+6.5g-0.2g}$×100%≈28.6%.
故答案為:(1)32.5%;
(2)恰好完全反應后所得溶液中溶質的質量分數為28.6%.
點評 本題難度不大,掌握根據化學方程式的計算即可正確解答本題,根據質量守恒定律計算出氫氣的質量是正確解答本題的前提和關鍵.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:解答題
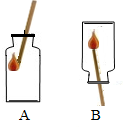 將兩裝滿氧氣的集氣瓶,按如圖所示,用帶火星的木條分別用A、B兩種方式迅速插入,觀察到木條復燃,且在A中燃燒比在B中燃燒更旺.從以上實驗現象可知氧氣的性質有:
將兩裝滿氧氣的集氣瓶,按如圖所示,用帶火星的木條分別用A、B兩種方式迅速插入,觀察到木條復燃,且在A中燃燒比在B中燃燒更旺.從以上實驗現象可知氧氣的性質有:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 物質序號 | 甲 | 乙 | 丙 | 丁 | 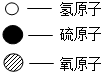 |
| 微觀示意圖 |  |  |  |  | |
| 反應前質量/g | 34 | 50 | 1 | 0 | |
| 反應后質量/g | 0 | x | y | z |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
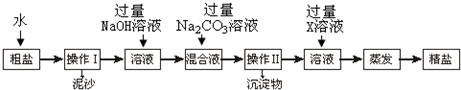

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com