
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑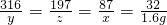
 K2MnO4+MnO2+O2↑;(2)高錳酸鉀分解后產生氧氣的質量是1.6g;(3)剩余固體中含有高錳酸鉀、錳酸鉀和二氧化錳,質量分別是0.2g、9.85g、4.35g;
K2MnO4+MnO2+O2↑;(2)高錳酸鉀分解后產生氧氣的質量是1.6g;(3)剩余固體中含有高錳酸鉀、錳酸鉀和二氧化錳,質量分別是0.2g、9.85g、4.35g;

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
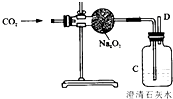 “嫦娥三號”飛船的成功發射是我國航天事業的又一里程碑.金屬過氧化物等可作宇宙飛船或潛水艇中的氧氣再生劑,如:過氧化鈉(Na2O2)在常溫下能與人呼出的二氧化碳反應生成氧氣和碳酸鈉;為了驗證該反應中氧氣的產生,某興趣小組的同學設計了如圖所示的實驗.
“嫦娥三號”飛船的成功發射是我國航天事業的又一里程碑.金屬過氧化物等可作宇宙飛船或潛水艇中的氧氣再生劑,如:過氧化鈉(Na2O2)在常溫下能與人呼出的二氧化碳反應生成氧氣和碳酸鈉;為了驗證該反應中氧氣的產生,某興趣小組的同學設計了如圖所示的實驗.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com