
向裝有等量水的A、B、C燒杯中分別加入10 g、
25 g、25 g NaNO3固體,充分溶解后,現象如圖一所示。
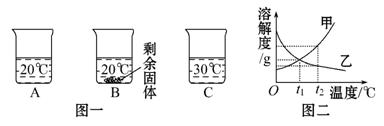
(1)燒杯中的溶液一定屬于飽和溶液的是 (填序號);
(2)圖二中能表示NaNO3溶解度曲線的是 (填“甲”或“乙”);
(3)要使B燒杯中剩余固體繼續溶解,可采用的方法是 ________;
(4)由圖二分析,若分別將100 g甲、乙的飽和溶液從t2℃降溫到t1℃,對所得溶液的敘述正確的是 (填序號)。
A.甲、乙都是飽和溶液 B.所含溶劑質量:甲<乙
C.溶液質量:甲>乙 D.溶質質量分數:甲>乙
(1)A、C中固體完全溶解不能判斷是否是飽和溶液,B中固體有剩余,一定是飽和溶液。(2)由圖一可以看出,NaNO3的溶解度隨著溫度的升高而增大,所以甲應該是NaNO3的溶解度曲線。(3)要使剩余的固體溶解,可以加水或升高溫度。(4)由于乙的溶解度隨著溫度的降低而增大,所以從t2℃降到t1℃乙變成不飽和溶液,A敘述不正確;t2℃甲的溶解度比乙大,100 g飽和溶液中所含的溶質甲比乙多,則溶劑的量甲小于乙,從t2℃降到t1℃,溶液中溶劑的質量不變,B敘述是正確的;從t2℃降到t1℃,甲析出晶體,乙溶液質量不變,所以溶液的質量甲應小于乙,C敘述不正確;t2℃時甲的溶解度大于乙的溶解度。故該溫度下甲飽和溶液溶質的質量分數大于乙飽和溶液溶質的質量分數,降溫至t1℃時甲溶解度降低,析出晶體,為t1℃時飽和溶液,乙的溶解度增大,溶質質量分數不變。由于甲t1℃時的溶解度大于t2℃時乙的溶解度,故t1℃時甲的溶質質量分數大于乙的溶質質量分數。
答案:(1)B (2)甲 (3)加水(或升溫) (4)B、D


科目:初中化學 來源: 題型:
青銅是人類最早使用的銅錫合金,下列說法中不正確的是
( )
A.青銅屬于純凈物 B.青銅屬于金屬材料
C.青銅的硬度比銅大 D.青銅耐腐蝕,易鑄造成形
查看答案和解析>>
科目:初中化學 來源: 題型:
小明發現家中一枚戒指生滿了銅綠,他和同學利用這枚戒指展開了研究性學習。
【查閱資料】真金在空氣中不會生銹,生滿銅綠的“金戒指”材質為銅鋅合金;銅長期露置在潮濕的空氣中能生成銅綠,其主要成分是堿式碳酸銅,堿式碳酸銅受熱易分解生成CuO、H2O和CO2。據上述資料可推知,堿式碳酸銅由__________種元素組成。
【實驗探究】將該枚戒指加入過量稀鹽酸中,有氣泡產生,溶液由無色逐漸變為藍綠色。
⑴小明認為:氣體 中除了含有CO2,還可能含有少量__________。實驗室常用__________的方法檢驗這種可能含有的氣體。
中除了含有CO2,還可能含有少量__________。實驗室常用__________的方法檢驗這種可能含有的氣體。
⑵小紅認為藍綠色溶液中的溶質只有氯化鋅。小華認為溶液中的溶質除了氯化鋅外,還應該含有____________________。他取適量上述藍綠色溶液,加入光亮的鐵片,觀察到了觀察:①______________________________,②______________________________,證實了自己的觀點。
⑶小娟取適量新制的FeCl2溶液,加入鋅粒,一段時間后,溶液顏色變淺。結合小華的實驗可推知:鐵、鋅、銅三種金屬的活動性由弱到強的順序是________________________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
配制溶質質量分數為5%的下列溶液,能達到目的的是 ( )
A.稱取5.0 g氯化鉀,溶解在95 mL水中,充分攪拌
B.稱取5.0 g氯化鉀,放入100 mL水中,充分攪拌
C.量取5.0 mL濃鹽酸,倒入95 mL水中,充分攪拌
D.稱取5.0 g碳酸鈣,放入95 mL水中,充分攪拌
查看答案和解析>>
科目:初中化學 來源: 題型:
已知金屬鈉和水能發生下列反應:
2Na+2H2O====2NaOH+H2↑,現將一定質量的金屬鈉放入75.6克水中,反應后生成8克氫氧化 鈉,計算:
鈉,計算:
(1)參加反應的水是多少克?
(2)反應后得到的氫氧化鈉溶液中溶質的質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:
固體CO2又稱干冰,易升華。干冰滅火器常用于撲救檔案資料室發生的火災。下列關于干冰滅火的說法不正確的是( )
A.干冰升華時吸熱,降低可燃物的著火點
B.CO2覆蓋在可燃物表面,隔絕空氣
C.CO2不能支持燃燒
D.干冰升華后不污染檔案資料
查看答案和解析>>
科目:初中化學 來源: 題型:
某同學需測定某100g過氧化氫溶液中所含過氧化氫的質量.他取10g二氧化錳放入燒杯中,并將該過氧化氫溶液全部加入,不同時間用電子天平測量其質量,所得讀數如表所示:
| 反應時間/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 燒杯及所盛物質總質量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(1)試分析,100g過氧化氫溶液完全反應后生成氧氣的質量為 .
(2)計算100g過氧化氫溶液中過氧化氫質量分數為多少?(寫出計算過程)
(3)請分析該方法測定結果可能會偏大的原因有 (寫出一點即可).
查看答案和解析>>
科目:初中化學 來源: 題型:
把A、B、C、D四種物質放在密閉容器中,在一定條件下充分反應,并測得反應物和產物在反應前后各物質的質量如下表所示,下列說法正確的是( )
| 物質 | A | B | C | D |
| 反應前的質量/g | 19.7 | 8.7 | 21.6 | 0.4 |
| 反應后的質量/g | 待測 | 19.4 | 0 | 3.6 |
A.物質C一定是化合物,物質D可能是單質
B.反應后密閉容器中A的質量為19.7 g
C.反應中,物質B和物質D質量比為87:36
D.該反應為化合反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com