
分析 (1)根據氧化鎂與稀硫酸反應生成硫酸鎂和水,鎂與稀硫酸反應生成硫酸鎂和氫氣解答;
(2)鎂和氧化鎂中的鎂元素完全轉化到硫酸鎂中,H2SO4溶液中硫酸根素完全轉化到硫酸鎂中;根據硫酸鎂中鎂和硫酸根的質量比可以求出硫酸鎂的種質量;
(3)根據鎂和氧化鎂中的鎂元素完全轉化到硫酸鎂中,利用元素守恒解答;
(4)根據質量守恒定律求出反應后溶液的質量.
解答 解:
(1)氧化鎂與稀硫酸反應生成硫酸鎂和水,反應的化學方程式為:MgO+H2SO4═MgSO4+H2O;鎂與稀硫酸反應生成硫酸鎂和氫氣,反應的化學方程式為:Mg+H2SO4═MgSO4+H2↑;
(2)147g溶質質量分數為10%的H2SO4溶液中硫酸根的質量=147g×10%×$\frac{96}{98}$×100%=14.4g
反應完成后生成MgSO4的質量為:14.4g÷$\frac{96}{120}$=18g
(3)鎂和氧化鎂中的鎂元素完全轉化到硫酸鎂中,18g硫酸鎂中,鎂元素的質量=18g×$\frac{24}{120}$=3.6g
鎂和氧化鎂中的氧元素=4.4g-3.6g=0.8g
該鎂帶樣品中MgO的質量為:0.8g÷$\frac{16}{40}$=2g,鎂元素質量=2g-0.8g=1.2g
未被氧化的鎂元素的質量=4.4g-2g=2.4g
其中未被氧化與已被氧化的鎂元素的質量比為:2.4g:1.2g=2:1;
(4)設2.4g鎂與酸反應生成氫氣的質量為x
Mg+H2SO4═MgSO4+H2↑;
24 2
2.4g x
$\frac{24}{2.4g}$=$\frac{2}{x}$
x≈0.2g
該溶液的質量為4.4g+147g-0.2g=151.2g
答案:
(1)MgO+H2SO4═MgSO4+H2O;Mg+H2SO4═MgSO4+H2↑;
(2)18;
(3)2;2:1;
(4)該溶液的質量為151.2g.
點評 本題難度不大,掌握利用化學方程式與溶質質量分數的綜合計算即可正確解答本題,解題時要注意解題的規范性.


科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
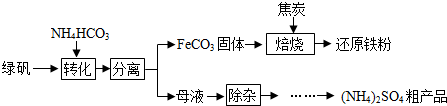
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
 實驗室有一瓶標簽受到腐蝕的無色溶液,如圖所示.這瓶無色溶液是放在存放鹽溶液的柜子里.化學興趣小組開展探究:
實驗室有一瓶標簽受到腐蝕的無色溶液,如圖所示.這瓶無色溶液是放在存放鹽溶液的柜子里.化學興趣小組開展探究:| 實驗操作 | 實驗現象 |
| ①取少重該無色溶液于試管中,慢慢滴加BaCl2溶液 ②靜置后,向沉淀中滴加稀鹽酸 | 產生白色沉淀 產生大量氣泡,沉淀全部溶解. |
| 實驗操作 | 實驗現象 |
| 取上述無色溶液少許于試管中,滴加少量的稀鹽酸 | 溶液中沒有氣泡產生(或有氣泡產生),該瓶無色溶液是硫酸鈉溶液(或碳酸鈉溶液) |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
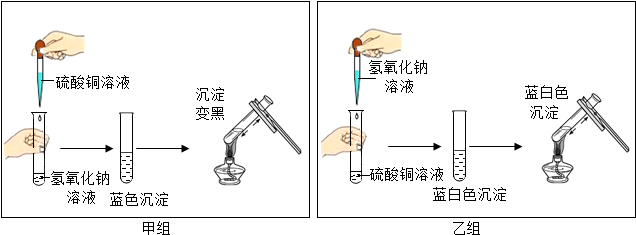
查看答案和解析>>
科目:初中化學 來源: 題型:多選題
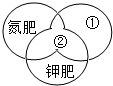 分類法是化學學習中常用的方法之一,如圖是根據組成元素不同對化學肥料的分類概念圖,下列敘述錯誤的是( )
分類法是化學學習中常用的方法之一,如圖是根據組成元素不同對化學肥料的分類概念圖,下列敘述錯誤的是( )| A. | CO(NH2)2、氨水、硝酸銨屬于氮肥 | B. | 硫酸鉀、氯化鉀、硝酸鉀屬于鉀肥 | ||
| C. | 圖中①表示的是磷肥 | D. | 圖中②表示復合肥 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 加熱 | B. | 加入適量純堿 | C. | 加入適量氯化鋇 | D. | 加入適量明礬 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com