小趙在實驗室用粗鋅和稀硫酸反應制取氫氣,他將10g鋅(雜質不與酸反應)加到100g稀硫酸中,恰好完全反應,剩余物質總質量為109.8g.問:稀硫酸質量分數?
【答案】
分析:根據質量守恒定律,由反應前后物質的總質量的差求得反應放出氫氣的質量;由生成氫氣的質量,根據反應的化學方程式,計算稀硫酸中所含硫酸的質量,硫酸質量與硫酸溶液質量比求得原硫酸溶液的溶質質量分數.
解答:解:根據質量守恒定律,反應放出氫氣的質量=100g+10g-109.8g=0.2g
設恰好完全反應消耗H
2SO
4的質量為x
Zn+H
2SO
4═ZnSO
4+H
2↑
98 2
x 0.2g
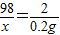
x=9.8g
原硫酸溶液的溶質質量分數=
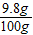
×100%=9.8%
答:原硫酸溶液的溶質質量分數為9.8%.
點評:根據質量守恒定律,找出反應所放出氫氣的質量,體現分析問題、解決問題的能力.
