
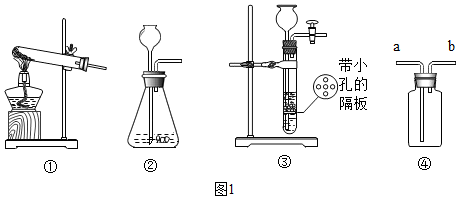
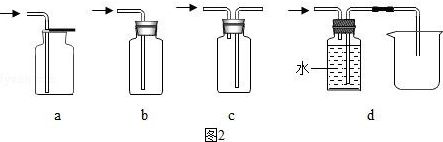
分析 (1)根據反應物的狀態和反應條件選擇發生裝置進行分析;
(2)根據裝置內外產生的氣壓差可以控制反應的發生和停止進行分析;
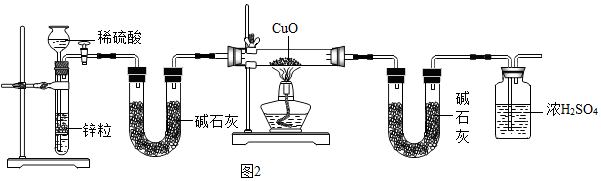
(3)根據鋅和稀硫酸反應生成硫酸鋅和氫氣進行分析;
(4)根據氨氣的密度比空氣小進行分析;
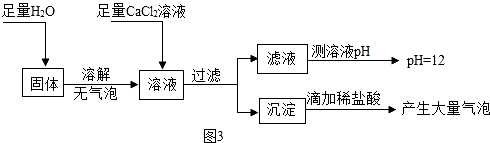
(5)根據通入硬試管中的氫氣要干燥,第一個裝有堿石灰的U形管的作用是除去氫氣中的水分;由裝置圖與實驗原理可知,第二個裝有堿石灰的U形管的作用是用于吸收反應產生的水,根據水的質量測定銅元素的相對原子質量Ar(Cu);
(6)根據過氧化氫在二氧化錳的催化作用下生成水和氧氣進行分析.
解答 解:(1)初中所學發生裝置主要分兩種,即固體加熱型、固體和液體不加熱型.A裝置屬于固體和固體加熱裝置,反應物是固體和固體,反應條件是加熱;
(2)實驗室用大理石和稀鹽酸制取二氧化碳,發生裝置屬于固體和液體不加熱制氣體;②和③相比,③裝置中導管多了一個開關,一旦開關關閉,隨著氣體的增多,迫使液體和多孔隔板上的固體分離,導致反應停止;
(3)鋅和稀硫酸反應生成硫酸鋅和氫氣,化學方程式為:Zn+H2SO4=ZnSO4+H2↑;
(4)因為氨氣易溶于水,密度比空氣小,故采用向下排空氣法收集,所以從短管(b)通入,把空氣從長管排出;
(5)通入硬試管中的氫氣要干燥,第一個裝有堿石灰的U形管的作用是除去氫氣中的水分;依據H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
氧化銅的質量為ag,反應后生成水的質量為bg,令銅的相對原子質量為x,則(x+16):18=ag:bg,解得x=$\frac{18a}{b}$-16;
(6)過氧化氫在二氧化錳的催化作用下生成水和氧氣,化學方程式為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故答案為:(1)反應物是固體,反應需要加熱;
(2)能隨時控制反應的開始和結束;
(3)Zn+H2SO4=ZnSO4+H2↑;
(4)b;
(5)吸收氫氣中的水蒸氣,$\frac{18a}{b}$-16;
(6)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
點評 本題主要考查常見氣體的發生裝置與收集裝置的探究,發生裝置依據反應物的狀態和反應條件選擇,收集裝置依據氣體的密度和溶解性選擇.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
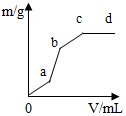 向用鹽酸酸化的MgSO4溶液中加入Ba(OH)2溶液,產生的沉淀質量m與加入溶液的體積V之間的關系如圖所示,關于該曲線的推測正確的是( )
向用鹽酸酸化的MgSO4溶液中加入Ba(OH)2溶液,產生的沉淀質量m與加入溶液的體積V之間的關系如圖所示,關于該曲線的推測正確的是( )| A. | a-b產生的沉淀為硫酸鋇 | |
| B. | a-b產生的沉淀為氫氧化鎂 | |
| C. | b-c產生的沉淀為硫酸鋇和氫氧化鎂 | |
| D. | b-c產生的沉淀為氫氧化鎂 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
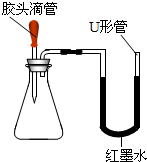 如圖是某同學設計的趣味實驗裝置,其氣密性良好.
如圖是某同學設計的趣味實驗裝置,其氣密性良好.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com