5.在一堂化學實驗課上,老師為每組同學分別提供了一瓶固體氫氧化鈉,讓大家進行實驗探究,請你參與.
探究活動一:探究酸堿中和反應
甲組同學按圖1所示進行實驗
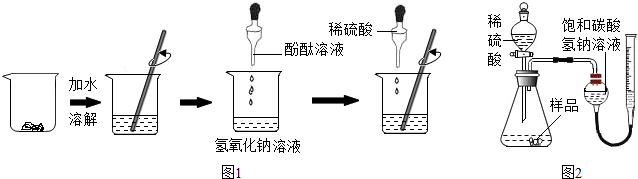
(1)往氫氧化鈉溶液中滴入無色酚酞溶液,觀察到的現象是溶液變紅色,說明溶液呈堿性.
(2)邊滴加稀硫酸,邊要用玻璃棒不斷攪拌的目的是使稀硫酸與氫氧化鈉成分混合,發生反應.
(3)當溶液顏色又恰好變為無色時,說明酸能與堿發生反應,測得此時溶液的pH=7.
乙組同學也按上述步驟進行實驗,但在滴加稀硫酸時,發現溶液有氣泡產生.同學們經討論一致認為是氫氧化鈉發生變質生成了碳酸鈉,于是進行如下探究:
探究活動二:測定乙組的氫氧化鈉樣品(以下簡稱樣品)中碳酸鈉的質量分數
資料摘要:Ⅰ.二氧化碳在飽和碳酸氫鈉溶液中幾乎不溶解
II.碳酸鈉溶液與氫氧化鋇溶液反應,產生白色沉淀.化學方程式如下:Na
2CO
3+Ba(OH)
2=BaCO
3↓+2NaOH
【方案一】氣體測定法
取一定量的樣品與足量稀硫酸在如圖2裝置中反應,測定產生的二氧化碳的體積.根據該實驗條件下二氧化碳的密度計算二氧化碳的質量,再根據相關計算得出樣品中碳酸鈉的質量分數.
(4)寫出稀硫酸與樣品中成分反應產生氣體的化學方程式Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑.
(5)某同學用水代替圖2裝置中的飽和碳酸氫鈉溶液進行收集和測量二氧化碳,發現所測氣體的體積偏小,原因是二氧化碳可以溶于水,與水反應.
【方案二】沉淀測定法
小明設計如圖所示實驗,測定碳酸鈉的質量分數.
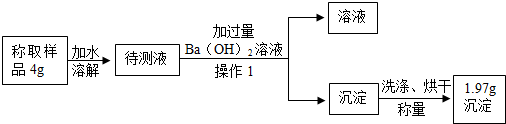
(6)“操作1”的名稱是過濾;Ba(OH)
2溶液過量的目的是充分除盡溶液中的碳酸鈉.
(7)1.97g的白色沉淀是碳酸鋇(填物質名稱),根據上述提供的實驗數據,計算出碳酸鈉的質量分數為26.5%.
(8)如果沉淀不洗滌就直接烘干、稱量,將導致結果偏高(選填“偏高”、“偏低”或“沒影響”).