
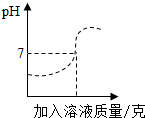
 稀HCl和NaOH溶液反應時的溶液酸堿度變化如圖所示
稀HCl和NaOH溶液反應時的溶液酸堿度變化如圖所示分析 依據鹽酸呈酸性,其PH小于7,氫氧化鈉溶液呈堿性,其PH大于7,氫氧化鈉溶液和鹽酸可以發生中和反應生成氯化鈉和水,恰好完全反應時其PH等于7,氫氧化鈉過量時顯堿性,鹽酸過量時顯酸性.據此分析解答.
解答 解:(1)圖象可以看出,開始反應時pH小于7,隨后pH逐漸增大,故該實驗時將氫氧化鈉溶液滴加到鹽酸溶液中;
(2)當溶液的pH=5時,溶液呈酸性,溶液中有剩余的鹽酸和生成的氯化鈉,故溶液中的溶質為:HCl、NaCl;
(3)設參加反應的NaOH質量為x
HCl+NaOH=NaCl+H2O
40 58.5
x 2.34g
$\frac{40}{58.5}=\frac{x}{2.34g}$ 解得:x=1.6g
故需要10%的NaOH溶液質量是:$\frac{1.6g}{10%}$=16g
故答案為(1)NaOH溶液;(2)HCl、NaCl;(3)有16量分數為10%的NaOH溶液參加反應.
點評 本題以圖象的形式考查了酸堿中和反應時溶液PH的變化,以及物質間的質量關系,完成此題,可以依據已有的知識進行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:解答題
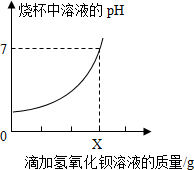 測定某品牌潔廁靈中硫酸質量.取20g該品牌的潔廁靈溶液于燒杯中,不斷滴加25g溶質質量分數為17.1%的氫氧化鋇溶液,反應過程中滴入氫氧化鋇溶液的質量和燒杯中溶液pH變化的部分數據如表所示:
測定某品牌潔廁靈中硫酸質量.取20g該品牌的潔廁靈溶液于燒杯中,不斷滴加25g溶質質量分數為17.1%的氫氧化鋇溶液,反應過程中滴入氫氧化鋇溶液的質量和燒杯中溶液pH變化的部分數據如表所示:| 滴加氫氧化鋇溶液的質量/g | 5 | 10 | X | 25 |
| 燒杯中產生沉淀的質量/g | 1.165 | 2.33 | 4.66 | 4.66 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 實驗步驟 | 實驗現象 | 分析與結論 |
| ①在盛有少量蒸餾水的燒杯中滴入2~3滴石蕊試液 | 液體顯紫色 | 結論: 蒸餾水不能使酚酞變紅 |
| ②在步驟①的燒杯中再滴加濃鹽酸 | 試液變紅 | 結論: 酸性溶液能使紫色石蕊試液變紅 |
| ③按圖甲所示進行實驗 | 燒杯B中試液變紅 | 原因: 由于濃鹽酸具有較強的揮發性,所以倒扣的燒杯中會有大量的氯化氫分子存在,這些氯化氫的分子溶于燒杯B中會使該溶液變為稀鹽酸而呈酸性,所以燒杯B中的紫色石蕊會變為紅色,結論: 分子是不斷運動的 |

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | CO2比CO多一個氧原子 | |
| B. | CO可用于冶煉鐵,因為CO具有還原性 | |
| C. | CO2與CO都是大氣污染物 | |
| D. | CO2能使濕潤的藍色石蕊試液變紅,故CO2具有酸性 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 2P+5O2$\frac{\underline{\;點燃\;}}{\;}$P2O5 | B. | 2CO+O2═2CO2 | ||
| C. | 2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | H2SO4+NaOH═NaSO4+H2O |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com