
【題目】某純堿(Na2CO3)樣品中含有少量氯化鈉。為測定樣品中碳酸鈉的質量分數,現稱取該樣品11g,加入到盛有50g稀鹽酸的燒杯中,恰好完全反應,最后稱得燒杯中溶液的質量為56.6g。(溫馨提示:Na2CO3+2HC1═2NaC1+H2O+CO2↑)計算:
①反應生成CO2氣體的質量是___g;
②純堿樣品中碳酸鈉的質量分數_____________g;
③若將最后燒杯中的溶液蒸干,可得________g氯化鈉固體?
【答案】 4.4 96.4% 12.1g
【解析】①根據質量守恒定律知,反應生成CO2氣體的質量是11g+50g-56.6g=4.4g。
②解∶設純堿樣品中碳酸鈉的質量分數為x,生成氯化鈉為y
Na2CO3+2HC1═2NaC1+H2O+CO2↑
106 `117 44
11g×x y 4.4g
![]() =
=![]() ,x=96.4%。
,x=96.4%。
![]() =
=![]() ,y=11.7g。
,y=11.7g。
③若將最后燒杯中的溶液蒸干,可得∶11.7g+11g×﹙1-96.4%﹚=12.1g。
答∶①反應生成CO2氣體的質量是4.4g;②純堿樣品中碳酸鈉的質量分數是96.4%;③若將最后燒杯中的溶液蒸干,可得12.1g氯化鈉固體。
點睛∶靈活應用質量守恒定律,正確書寫化學方程式是順利完成本題的重要保證。


科目:初中化學 來源: 題型:
【題目】“人工固氮”的新方法的反應過程示意圖如下:
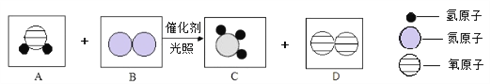
(1)依據反應的微觀示意圖寫出化學方程式____________。
(2)氨氣進入大氣后與雨水作用,可能形成“堿雨”。寫出堿雨中的堿的化學式,并標出其中氮元素的化合價________________。
(3)氨是氮肥工業的重要原料。某化肥廠生產銨態氮肥(NH4)2SO4的工藝流程如下:

① 加入的X 應為________________(填字母序號)。
A.H2SO4 B.CaSO4 C.SO2
②生產流程中能被循環利用的物質是_________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】有一混合氣體,經測定只含有甲烷和一氧化碳,現將 11.6g 該混合氣體在氧氣中充分燃燒,并 將生成物先后依次通過足量的濃硫酸和堿石灰(已知:堿石灰是氫氧化鈉和氧化鈣的混合物), 確保每一步都被充分吸收,測得濃硫酸增重 7.2g。下列說法不.正.確.的是
A. 堿石灰增 22g B. 混合氣體中一氧化碳質量為 8.4g
C. 混合氣體中碳、氫元素的質量比為 15:2 D. 混合氣體中甲烷與一氧化碳分子數之比為 3:2
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖所示的裝置可用來測定某氣體X的組成。在注射器A中裝有0.32g氣體X并慢慢通過不含空氣并裝有足量灼熱的氧化銅的玻璃管B,使氣體X完全反應。得到以下實驗結果:實驗前B管重20.32g,實驗后B管重20.00g,B管中出現紅色粉末。C管中收集到的無色液體是水;注射器D中收集到生成氮氣0.28g。下列說法正確的是( )
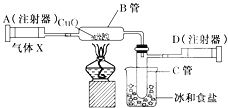
A. B管中發生的反應為置換反應
B. 氣體X是氨氣(NH3)
C. 該反應中生成的水與氮氣的分子個數比為1:2
D. 氣體X中氮元素與氫元素的質量之比為7:1
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】化學用語是學習化學的重要工具,是國際通用的化學語言。
(1)請用化學用語填空:
①人體缺乏后會引起貧血的元素 ;
②兩個氫原子 ;
③三個二氧化硫分子 ;
④四個氫氧根離子 ;
(2)在符號“![]() ”中H正上方的“+1”表示 ,H右下角的“2”表示 。
”中H正上方的“+1”表示 ,H右下角的“2”表示 。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】NaCl、KNO3的溶解度曲線如圖甲,20℃時取18g KNO3 和18gNaCl分別放入兩只燒杯中,各加50g水充分溶解,現象如圖乙所示;升溫到50℃時,現象如圖丙所示。
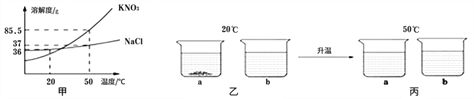
請回答下列問題:
(1)乙圖中,a燒杯溶液中溶質的質量分數_______b燒杯溶液中溶質的質量分數(選填“>” “<”或“=”) 。
(2)要使丙圖中的NaCl溶液恰好變成飽和溶液,需要加入_______g NaCl固體。
(3)除去固體KNO3中混有的少量NaCl,實驗步驟:先加水加熱溶解,再______,然后過濾、洗滌、干燥。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】NaCl和KNO3的溶解度曲線如圖所示。下列說法正確的是
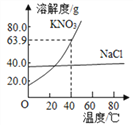
A. KNO3、NaCl都是“微溶于水”的物質
B. 常用冷卻熱飽和溶液的方法使NaCl結晶
C. 20℃的KNO3飽和溶液升溫至60℃,溶液的濃度變大
D. 40℃時將32g KNO3放入50g水中,所得溶液的溶質質量分數約為39%
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】無機非金屬材料中,用于電子工業的高純碳酸鈣、高純氧化鈣生產流程如下:
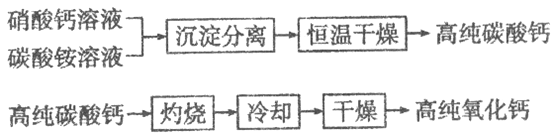
請回答下列問題:
(1)硝酸鈣與碳酸銨在溶液中反應,其基本反應類型為___________。
(2)高純氧化鈣生產過程中,“干燥”的主要目的是為了防止__________________ (用化學方程式表示)。
(3)生產高純碳酸鈣時,選擇“220℃恒溫干燥”而不選擇“灼燒”的原因是_______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列實驗方法一定能達到實驗目的的是
選項 | 實驗目的 | 實驗方法 |
A | 檢驗一瓶氣體是否為 | 將燃著的木條伸入瓶中 |
B | 鑒別 | 分別點燃,在火焰上方罩一干冷燒杯 |
C | 鑒別石灰水和 | 加入適量的稀鹽酸 |
D | 比較Zn、Cu、Ag的金屬活動性 | 將Zn和Ag分別放入 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com