

分析 (1)根據加入氫氧化鈉后沒有立即出現沉淀,說明加入的NaOH溶液先跟其中的硫酸反應,后跟硫酸鎂反應進行分析;
(2)根據圖乙中pH的變化分析與硫酸鎂反應的氫氧化鈉的質量;再根據氫氧化鈉與硫酸鎂反應的方程式計算硫酸鎂的質量、生成的沉淀的質量等,即可進行有關的計算.
(3)據圖乙中pH的變化分析在c點混合溶液與NaOH恰好反應完全,據此判斷溶液中的溶質;
(4)根據上述數據做出加入氫氧化鈉溶液的質量與產生沉淀質量的關系圖;
解答 解:(1)向H2SO4和MgSO4的混合溶液中加入NaOH溶液,氫氧化鈉首先與硫酸反應,溶液的pH逐漸變大,當pH等于7時硫酸恰好完全反應,所以,圖乙的圖象中,ab段表示的是混合溶液中的H2SO4與NaOH發(fā)生反應;
(2)由圖乙中pH的變化可知,與硫酸鎂反應的氫氧化鈉的質量為:90g-50g=40g
設:100g混合液中硫酸鎂的質量為x,生成沉淀的質量為y
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80 58
x 40g×20% y
$\frac{120}{x}=\frac{80}{40g×20%}=\frac{58}{y}$ 解得:x=12g y=5.8g
該混合溶液中MgSO4的溶質質量分數是:$\frac{12g}{100g}×100%$=12%
(3)在c點,混合溶液與NaOH恰好反應完全,此點溶液中的溶質是Na2SO4;
(4)由上述分析可知,當加入氫氧化鈉溶液50g起開始產生沉淀,當加入到90g時硫酸鎂完全反應產生了沉淀是5.8g,所以,加入氫氧化鈉溶液的質量與產生沉淀質量的關系圖如下: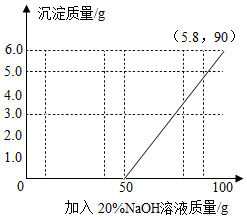
故答為:(1)H2SO4;(2)40,12%;(3)Na2SO4;(4)見上圖.
點評 本題主要考查了化學方程式的計算,難度不大,注意解題的規(guī)范性和準確性.


 云南師大附小一線名師提優(yōu)作業(yè)系列答案
云南師大附小一線名師提優(yōu)作業(yè)系列答案 沖刺100分單元優(yōu)化練考卷系列答案
沖刺100分單元優(yōu)化練考卷系列答案科目:初中化學 來源: 題型:選擇題
| A. | C CaO NaHSO4 | B. | H2 H2O NaOH | C. | O2 NaOH H2SO4 | D. | Fe CO2 H3PO4 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
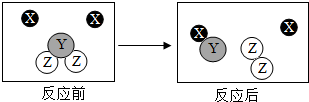 如圖是某化學變化的微觀示意圖,X、Y、Z分別表示不同類別的原子,下列敘述錯誤的是( )
如圖是某化學變化的微觀示意圖,X、Y、Z分別表示不同類別的原子,下列敘述錯誤的是( )| A. | 該化學反應中生成物的分子個數比為1:1 | |
| B. | 從微觀角度分析,化學反應前后各物質質量總和相等的原因是,化學反應前后原子和種類、數目和質量都沒有改變 | |
| C. | 該化學反應的基本類型為置換反應 | |
| D. | 由X原子構成的物質是該反應的催化劑 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
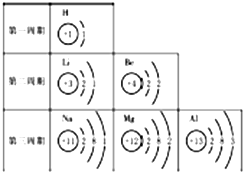 結合表中(元素周期表的部分)中原子結構示意圖,回答有關問題.
結合表中(元素周期表的部分)中原子結構示意圖,回答有關問題.查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com