某混合物由Na2SO4和Na2SO3組成,已知其中氧元素的質(zhì)量分?jǐn)?shù)為40%,則鈉元素的質(zhì)量分?jǐn)?shù)為( )
A.24.62%
B.25.09%
C.35.38%
D.無法確定
【答案】
分析:本題按常規(guī)進行計算,因缺少數(shù)據(jù),無法計算.通過觀察分析Na
2SO
4和Na
2SO
3組成就會發(fā)現(xiàn):其中的鈉原子和硫原子的個數(shù)比始終是2:1,也就是說不論Na
2SO
4和Na
2SO
3以任意質(zhì)量比混合,混合物中鈉元素與硫元素的質(zhì)量比都是定值,并能求出質(zhì)量比,混合物的組成元素有鈉、硫、氧三種元素,其中氧元素的質(zhì)量分?jǐn)?shù)是為40%,那么,鈉元素與硫元素的質(zhì)量分?jǐn)?shù)之和是1-40%=60%,由此可以求出鈉元素的質(zhì)量分?jǐn)?shù).
解答:解:分析比較Na
2SO
4和Na
2SO
3組成特點可知,不管混合物中各組分以任意質(zhì)量比混合,其中的鈉原子和硫原子的個數(shù)比始終是:2:1;根據(jù)元素質(zhì)量比的計算可得,該混合物中鈉元素和硫元素的質(zhì)量比為;(23×2):(32×1)=23:16
又因為該混合物中氧元素的質(zhì)量分?jǐn)?shù)是40%,所以該混合物中鈉元素的質(zhì)量分?jǐn)?shù)是:
(1-40%)×
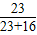
×100%═35.38%;
因此,C正確,A、B、D錯誤.
故選C.
點評:本題不但考查了化學(xué)式的意義,而且考查了元素質(zhì)量比的計算和元素質(zhì)量分?jǐn)?shù)的計算,更考查了混合物中某元素的質(zhì)量分?jǐn)?shù)的復(fù)雜計算等,在混合物中的元素質(zhì)量分?jǐn)?shù)的計算題中,不能盲目的直接代入公式計算,本題只有認(rèn)真細(xì)致地分析推算出混合物中各個組成成分的化學(xué)式的共同的特點(即其中的某原子和某原子的個數(shù)比是相同的),才有可能計算出正確的答案;否則,是非常難以解答的.

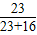 ×100%═35.38%;
×100%═35.38%;

 特高級教師點撥系列答案
特高級教師點撥系列答案