
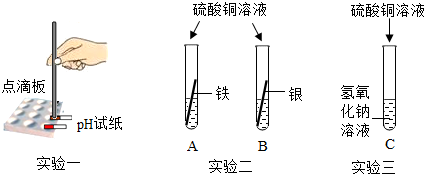
分析 (1)實驗一:pH的范圍是0-14之間;①當pH=7時,溶液呈中性;②當pH<7時,溶液呈酸性;③當pH>7時,溶液呈堿性;
實驗二:根據金屬活動順序進行分析.在金屬活動順序表中,前邊的金屬可以把后邊的金屬從其鹽溶液中置換出來;
實驗三:硫酸銅與氫氧化鈉反應生成硫酸鈉和氫氧化銅;
(2)【猜想假設】根據反應情況分析;
【實驗驗證】根據酚酞試液變紅,得出溶液是堿性的結論.
【拓展遷移】氫氧化銅與硫酸反應生成硫酸銅和水.
解答 解:(1)實驗一:用pH試紙測得pH<7,則說明硫酸銅溶液呈酸性;
實驗二:鐵與硫酸銅反應生成硫酸亞鐵和銅,鐵表面會附著紅色物質,溶液逐漸由藍色變為淺綠色,因為生成的硫酸亞鐵的溶液呈淺綠色所以隨著反應的進行溶液逐漸變為淺綠色.證明鐵的活動性大于銅,而試管B中無明顯現象,證明銀的活動性小于銅;所以三種金屬活動性由強到弱的順序依次是鐵>銅>銀;
實驗三:硫酸銅與氫氧化鈉反應生成硫酸鈉和氫氧化銅,方程式為:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
(2)【猜想假設】硫酸銅與氫氧化鈉恰好反應,濾液中溶質為Na2SO4.如果硫酸銅過量,濾液中溶質為Na2SO4和CuSO4;如果氫氧化鈉過量,濾液中溶質為Na2SO4和NaOH.又因為無色濾液,所以硫酸銅不可能過量.
【實驗驗證】向其中滴加幾滴無色酚酞溶液,溶液變紅,說明含有NaOH,所以濾液中溶質為Na2SO4和NaOH.
【拓展遷移】氫氧化銅與硫酸反應生成硫酸銅和水.
故答案為:(1)實驗一:酸;
實驗二:鐵表面會附著紅色物質,溶液逐漸由藍色變為淺綠色;鐵>銅>銀;
實驗三:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
(2)【猜想假設】兩;
【實驗驗證】Na2SO4和NaOH.
【拓展遷移】稀硫酸.
點評 實驗現象是物質之間相互作用的外在表現,因此要學會設計實驗、觀察實驗、分析實驗,為揭示物質之間相互作用的實質奠定基礎.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
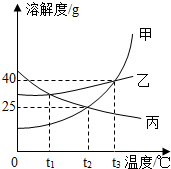 如圖為甲、乙、丙三種固體物質的溶解度曲線,請回答.
如圖為甲、乙、丙三種固體物質的溶解度曲線,請回答.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | K+、Cl-、NO3-、OH- | B. | K+、NO3-、OH- | C. | K+、Cl-、OH- | D. | K+、OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com