
32.5g/50g×100%=65% (1分) 39.2g/80g×100%=49%(1分)
答:黃銅屑樣品中的鋅的質量分數為65%,所用稀硫酸中溶質的質量分數為49%。(1分)
(3)(共1分,得分點:起點、折點、曲線趨勢等,錯一處即不得分
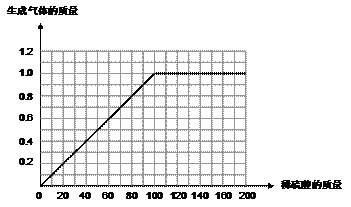 )
)
17.(共8分)
(1)硫酸(1分)
(2)解:設參加反應的鋅的質量為x ,參加反應的硫酸的質量為y 。
 Zn+H2SO4===ZnSO4+H2↑
Zn+H2SO4===ZnSO4+H2↑(化學方程式1分)
Zn+H2SO4===ZnSO4+H2↑
Zn+H2SO4===ZnSO4+H2↑(化學方程式1分)
65 2 98 2
x 1.0 g y g 0.8 g
65∶2=x∶1.0 g 98∶2=y∶0.8 g
x=32.5g(1分) y=39.2g(1分)
∴黃銅屑樣品中的鋅的質量分數為 ∴所用稀硫酸中溶質的質量分數為
17.(09黔東南)某同學為了測定黃銅屑(由鋅和銅形成的合金)樣品組成,取四份樣品分別加稀硫酸反應,其實驗數據記錄如下表。
|
樣品 |
第1份 |
第2份 |
第3份 |
第4份 |
|
取樣品質量(g) |
50.0 |
50.0 |
50.0 |
50.0 |
|
取稀硫酸質量(g) |
40.0 |
80.0 |
120.0 |
160.0 |
|
產生氣體質量(g) |
0.4 |
0.8 |
1.0 |
1.0 |
試計算:
⑴經分析,在第1份樣品測得的數據中, (填物質)完全反應了。(1分)

⑵列式計算黃銅屑樣品中的鋅的質量分數和所用稀硫酸中溶質的質量分數。(6分)

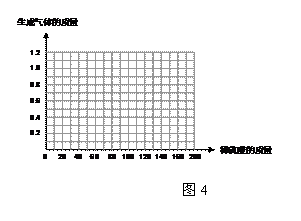 ⑶請在圖4中畫出在50.0g樣品中加稀 酸的質量與產生氣體質量變化關系的示意圖。(1分)
⑶請在圖4中畫出在50.0g樣品中加稀 酸的質量與產生氣體質量變化關系的示意圖。(1分) 
19、(09臨沂)我國約在南北朝時就開始冶煉黃銅。黃銅是銅和鋅的合金(Cu-Zn),它可用來制造及其、電器零件及日用品。為了測定某黃銅樣品中鋅的質量分數(不考慮黃銅中的其他雜質),現將15mL稀鹽酸分三次加入到5g黃銅樣品粉末中,每次充分反應后,測定生成氫氣的質量,實驗數據見下表:
|
|
第一次 |
第二次 |
第三次 |
|
加入稀鹽酸的體積(mL) |
5 |
5 |
5 |
|
生成氫氣的質量(g) |
0.04 |
m |
0.02 |
試求:
(1) m= 。
(2)此黃銅樣品中鋅的質量分數是多少?
34.(09嘉興)某同學發現金屬眼鏡架表面經常會有綠色物質產生,這是什么物質呢?他和同學們收集積累了一定量的這種綠色物質,放在試管里隔絕空氣加熱。觀察到試管內壁有水珠,綠色物質變成黑色粉末,產生的氣體能夠使澄清石灰水變渾濁。
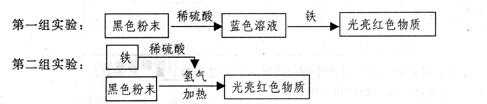 (1)實驗表明:鏡架上的綠色物質中一定含有 ▲ 元素。鏡架上會產生綠色的銹,這綠色物質中是否含有銅呢?同學們用上述試管中的黑色粉末分兩組分別進行了實驗:
(1)實驗表明:鏡架上的綠色物質中一定含有 ▲ 元素。鏡架上會產生綠色的銹,這綠色物質中是否含有銅呢?同學們用上述試管中的黑色粉末分兩組分別進行了實驗:
(2)大部分同學認為第一組實驗方法比較理想,試簡要說明理由。 ▲
26.(10分)
(1)  (2)2.8g
(2)2.8g
(3)由表中數據分析,實驗Ⅲ中100g稀硫酸完全反應。
設實驗Ⅲ生成硫酸亞鐵的質量為x,消耗鐵的質量為y。
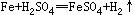
56 152 2
y x 0.2g
=,x=15.2g =,y=5.6g
所得溶液中溶質的質量分數為×100%=14.4%。
答:略。
.
26.(09濰坊)(10分)某化學調查小組的同學到鋼鐵廠做社會調查。他們抽取組成完全相同的質量為2.84g、4.26g、6.23g的三份鋼樣(假設鋼樣中只含鐵和碳),分別加入100g稀硫酸中進行實驗(實驗I、Ⅱ、Ⅲ),充分反應后,將得到的實驗數據繪制出如下圖像:
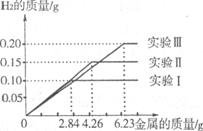 試回答(計算結果精確到0. 1%):
試回答(計算結果精確到0. 1%):
(1)寫出實驗中有關的化學方程式:
(2)實驗I中鐵參加反應的質量為 。
(3)稀硫酸完全參加反應的實驗中,反應后溶液中溶質的質量分數是多少。
30.(1) Mg+H2SO4=MgSO4+H2↑ (2) Cu 5 2.5 (3) 80% (4) 20.4%
30.(09泰州)(8分)某化學興趣小組為了測定鎂銅合金中鎂的質量分數,取出3g合金樣品,將60g稀硫酸分6次加入樣品中,充分反應后過濾、洗滌、干燥、稱重,得到的實驗數據如下:
|
稀硫酸用量 |
剩余固體質量 |
|
第一次加入10g |
mg |
|
第二次加入10g |
2.0g |
|
第三次加入10g |
1.5g |
|
第四次加入10g |
1.0g |
|
第五次加入10g |
0.6g |
|
第六次加入10g |
0.6g |
(1)測定過程中發生反應的化學方程式為 ▲ ;
(2)從以上數據可知,最后剩余的0.6g固體的成分是 ▲ ;這六次實驗中,第 ▲ 次加入稀硫酸時樣品中的鎂已經完全反應;表格中,m= ▲ 。
(3)計算合金樣品中鎂的質量分數。
(4)計算所用稀硫酸中H2SO4的質量分數。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com