
題目列表(包括答案和解析)
化學中質量守恒定律是一個非常重要的定量定律。
(1)如下圖裝置中,稱量小燒杯中所有物質的質量m1,然后將小燒杯中的碳酸鈉與鹽酸完全混合,反應發生一段時間后,再稱量小燒杯及燒瓶內物質的總質量為 m2,則(填“=” “>”“<”)m1 m2 ,其原因為 。

(2)天然氣的主要成分是甲烷(CH4),可直接用作氣體燃料。燃燒反應前后分子種類變化的微觀示意圖如下所示。
①1個B分子中含有 個原子。
②四種物質中屬于化合物的是 (填圖中字母)。
(3)A和B可發生如下反應:3A+2B=A3B2,某學生做了3次該實驗(每次均充分反應),反應前A和B的質量 和都是l0g。有關實驗數據見下表:
序號 反應前A的質量 反應前B的質量 反應后A3B2的質量
① 8g 2g 6g
② 4g 6g 6g
③ xg yg 9g
X∶Y的比值可能為 或 。
(4)為了測定某品牌食用純堿中碳酸鈉的質量分數,某校化學研究性學習小組的探究過程如下:
《提出問題》樣品中碳酸鈉的質量分數是多少?
《知識準備》食用純堿的主要成分是碳酸鈉,另外還含有少量的氯化鈉;反應過程中不考慮水和氯化氫的揮發。
《設計方案》(1)方案一:向一定量樣品中加入過量澄清石灰水,根據反應生成碳酸鈣的質量,先求出碳酸鈉的質量,再計算樣品中碳酸鈉的質量分數。
(2)方案二:向一定量樣品中加入足量的稀鹽酸,根據反應生成二氧化碳的質量,先求出碳酸鈉的質量,再計算樣品中碳酸鈉的質量分數。
《進行實驗》甲組同學:稱取24.00g樣品,加水配成溶液,在溶液中加入過量的澄清石灰水。過濾、洗滌、干燥,共得到白色沉淀20.00g。
乙組同學:稱取24.00g樣品,加入足量的稀鹽酸直到反應停止,共收集到8.80g二氧化碳。
《解決問題》請你任選一組同學的實驗結果,幫助他們計算出樣品中碳酸鈉的質量分數。(寫出計算過程。計算結果精確到0.1% )


化學中質量守恒定律是一個非常重要的定量定律。
(1)如下圖裝置中,稱量小燒杯中所有物質的質量m1,然后將小燒杯中的碳酸鈉與鹽酸完全混合,反應發生一段時間后,再稱量小燒杯及燒瓶內物質的總質量為 m2,則(填“=” “>”“<”)m1 m2,其原因為 。 
(2)天然氣的主要成分是甲烷(CH4),可直接用作氣體燃料。燃燒反應前后分子種類變化的微觀示意圖如下所示。
①1個B分子中含有 個原子。
②四種物質中屬于化合物的是 (填圖中字母)。
(3)A和B可發生如下反應:3A+2B=A3B2,某學生做了3次該實驗(每次均充分反應),反應前A和B的質量 和都是l0g。有關實驗數據見下表:
序號 反應前A的質量 反應前B的質量 反應后A3B2的質量
① 8g 2g 6g
② 4g 6g 6g
③ xg yg 9g
X∶Y的比值可能為 或 。
(4)為了測定某品牌食用純堿中碳酸鈉的質量分數,某校化學研究性學習小組的探究過程如下:
《提出問題》樣品中碳酸鈉的質量分數是多少?
《知識準備》食用純堿的主要成分是碳酸鈉,另外還含有少量的氯化鈉;反應過程中不考慮水和氯化氫的揮發。
《設計方案》(1)方案一:向一定量樣品中加入過量澄清石灰水,根據反應生成碳酸鈣的質量,先求出碳酸鈉的質量,再計算樣品中碳酸鈉的質量分數。
(2)方案二:向一定量樣品中加入足量的稀鹽酸,根據反應生成二氧化碳的質量,先求出碳酸鈉的質量,再計算樣品中碳酸鈉的質量分數。
《進行實驗》甲組同學:稱取24.00g樣品,加水配成溶液,在溶液中加入過量的澄清石灰水。過濾、洗滌、干燥,共得到白色沉淀20.00g。
乙組同學:稱取24.00g樣品,加入足量的稀鹽酸直到反應停止,共收集到8.80g二氧化碳。
《解決問題》請你任選一組同學的實驗結果,幫助他們計算出樣品中碳酸鈉的質量分數。(寫出計算過程。計算結果精確到0.1% )


 CaO+CO2↑,這一化學反應要________(填“產生”或“吸收”)熱量.
CaO+CO2↑,這一化學反應要________(填“產生”或“吸收”)熱量.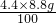
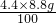 8.8g
8.8g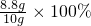 =88%
=88%一、選擇題(本大題共10題,每小題2分,共20分)每小題給出的四個選項中,只有一個最符合題意,請將其序號涂在答題卡上。
題號
1
2
3
4
5
6
7
8
9
10
答案
B
B
C
D
C
D
B
D
C
A
二、選擇題(本大題共5題,每小題2分,共10分)每小題給出的四個選項中,有1~2個符合題意。只有一個選項符合題意的多選不給分;有2個選項符合題意的只選一個且符合題意給1分,若選2個有一個不符合題意則不給分。
題號
11
12
13
14
15
答案
B
C
BD
C
B
三、(本大題共5題 共18分)
16.(6分)(每空1分) (6分)(1)①b ②a ③c ④d(2)①氧的元素符號為O
②氧的原子序數為8(或氧的相對原子質量為16.00等) (合理答案即給分)
17.(3分)(每空1分) (1)③⑤ (2)CO2和H2O (3)I
18.(2分)(每空1分) 酸 ①
19.(5分)(每空1分) (1)3 39.5% (2)①等于 ②不飽和 44.4%
20.(2分) 2:17
四、(本大題共5題 共42分)
(2)3Fe+2O2======Fe3O4
(3)Zn+H2SO4=====ZnSO4+H2↑
(4)HCl+NaOH ====NaCl+H2O
22.(7分) (每空1分,化學方程式2分) (1)把帶火星的木條插入集氣瓶中,帶火星的木條復燃
(2)催化
(3)
(4)溶解、過濾 燒杯、漏斗、玻璃棒、鐵架臺(帶鐵圈)
 (5)Fe
(5)Fe 
23.(6分) (每空1分,化學方程式2分)(1)2H2O2 2H2O+O2↑
(2)①③⑤⑦(A套) ①③⑦⑧⑨(B套)
①③④⑤⑥(C套) ①③④⑥⑧⑨(D套)
(3)裝置簡單(對應A、B套裝置)
添加藥品方便(對應C、D套裝置)
(4)將帶火星的木條放在集氣瓶口復燃(對應A、C套裝置)
集氣瓶口有氣泡冒出(對應B、D套裝置)
(5)用分液漏斗(或注射器)加入酸液(能控制反應速率的改進方案均可)
評分說明:本小題每空1分。本小題(2)答出一套即可,序號不分先后。本小題(3)(4)答案和(2)要有對應關系。本小題(3)(4)(5)答案不唯一,答案合理即可。
24.(11分) (每空1分,化學方程式2分)(1)②③④(2)趕走管內的空氣,防止爆炸
CO2 + C  2 CO
3 CO + Fe2O3
2 CO
3 CO + Fe2O3  2 Fe + 3 CO2
2 Fe + 3 CO2
(3)稍過量鐵粉 Fe、Cu
(4)與空氣中的O2、H2O同時接觸 CO2 保持金屬及金屬制品表面的潔凈與干燥
25.(10分) (每空1分)
【猜想或假設】pH=7;pH>7
【設計和實驗】②③
【評價與反思】甲;乙同學:pH試紙不能潤濕;丙同學:pH試紙不能直接放入待測溶液中;
【結論與分析】不正確;碳酸鈉是鹽,但其水溶液顯堿性。
五、(本大題共2題 共10分)
26.(4分)求出H2 0.5g得1分,Fe 14g得1分,生鐵的純度為96.6%得2分。
27.(6分) (1)7.3 (1分)
(2)二(1分) 碳酸鈣要在高溫下才能完全分解(1分)
(3)解:設與氫氧化鈉反應的HCl質量為x
HCl + NaOH===NaCl+H2O
|