
題目列表(包括答案和解析)
CO2是一種常見的氧化物。
(1)CO2能與堿反應,寫出它與Ba(OH)2溶液反應的化學方程式:
(2)CO2有廣泛的用途。工業上可用CO2生產小蘇打:一定條件下,向飽和氯化鈉溶液中通入氨氣(NH3)和CO2,即可析出碳酸氫鈉固體,此時溶液變渾濁;過濾,濾液中含有氯化銨。該反應的化學方程式是(提示:方程式配平后,物質化學式前的化學計量數均為1)
;
(3)化石燃料燃燒產生大量CO2。大氣中CO2含量過高會導致溫室效應等環境問題。
①天然氣(主要成分為CH4)完成燃燒的化學方程式是 ;
②計算1g CH4完全燃燒產生CO2的質量m(精確到0.01g);
③從下表數據分析,與煤相比,用天然氣做燃料的優點是 。
| 1g物質完全燃燒產生CO2的質量 | 1g物質完全燃燒放出的熱量 | |
| CH4 | m | 56KJ |
| C | 3.67g | 32KJ |
下圖中甲、乙、丙是初中化學中常見的物質,圖中“—”表示相連的物質之間可以在溶液中發生化學反應,“→”表示由某種物質可轉化為另一種物質(部分反應物、生成物及反應條件已略去)。下列說法中不正確的是 ( )
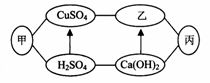 A.甲、乙、丙可能依次為Fe、NaOH、CO2
A.甲、乙、丙可能依次為Fe、NaOH、CO2
B.丙物質只能是氧化物或鹽
C.當乙為NaOH時,它可由Ca(OH)2與Na2CO3反應生成
D.當甲為一種堿時,它與硫酸銅溶液的反應可能產生兩種沉淀
震后災區預防某類病毒的方法是消毒,常見的堿類物質、甲醛等都有較好的殺死病毒
的作用。其中NaOH溶液因消毒效果好且廉價易得被廣泛使用,從而使工業燒堿用量增加。但工業燒堿中含有雜質碳酸鈉,為了測定氫氧化鈉的質量分數,某工廠甲、乙兩實驗員分別設計了實驗方案:
Ⅰ 甲的方案是:準確稱量一定質量的燒堿樣品于燒杯中加蒸餾水溶解,再加入過量氯化鋇溶液至沉淀完全,過濾、洗滌、烘干、稱量。
(1)甲實驗員洗滌沉淀的具體操作是:向沉淀中加入蒸餾水,然后過濾,重復2~3次 。確認沉淀已洗滌干凈的依據是
。
(2)氯化鋇溶液和氯化鈣溶液都能與該樣品溶液反應生成沉淀,但使用氯化鋇溶液比氯化鈣溶液所得的結果具有更高的精確度,原因是
。
Ⅱ 乙的方案如下圖所示:

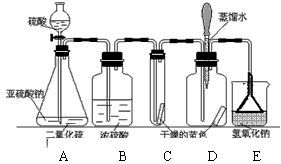
(1)根據乙的實驗裝置圖分析,濃硫酸的作用是 ,堿石灰的作用是 。小明認為按照乙的方案進行測定,會導致不可避免的誤差,例如:裝置內空氣中的CO2沒有排出;反應產生的CO2未被完全吸收等。該設計中還有一個因素也會導致不可避免的誤差,你認為是下列因素中的(填序號) 。
①裝置的氣密性不好 ②加入的稀硫酸量不足 ③干燥管與空氣直接相通
(2)經測定知,該工業燒堿中氫氧化鈉的質量分數為80%,某養殖戶需配制2000g 2%的氫氧化鈉溶液對禽舍進行殺菌消毒,需要這種工業燒堿 g。
堿石灰是氧化鈣和氫氧化鈉的固體混合物,是實驗室常用的干燥劑。相關信息如下圖所示。同學們為確認一瓶久置的“堿石灰”(可能已部分變質或全部變質)樣品的成分,進行如下探究。

[提出問題]實驗室中久置的堿石灰樣品的成分是什么?
[進行猜想] 久置的堿石灰樣品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化學方程式表示樣品中含有Ca(OH)2或Na2CO3可能含有的原因 (寫一個)
[探究過程]

試回答下列問題:
(1)操作①的名稱是 ,溶液C中一定含 離子。
(2)溶液A中加入CaCl2溶液后產生固體,說明樣品中一定含有 ,反應的方程式為 。
(3)向溶液A中加入CaCl2溶液后,證明CaCl2溶液過量的方法是 。
[實驗結論]
依據上述實驗操作過程及現象,綜合對濾液和固體成分的探究,下列對樣品成分的分析正確的是 (填序號)
①樣品中一定含NaOH ②樣品中一定含Na2CO3 ③樣品中含NaOH、CaO中的一種或兩種
[拓展延伸]
為測定實驗室中一瓶變質的燒堿中NaOH的含量,某同學取適量的燒堿樣品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分攪拌到不再放出氣泡為止,稱量溶液為395.6g。請分析計算:
(1)反應產生的CO2的質量為 g。
(2)若所取燒堿樣品為50.0g,則樣品中NaOH的質量分數是多少?(寫出計算過程)
(3)用同濃度的硫酸,分別與未變質、部分變質、或全部變質(雜質都是Na2CO3)的燒堿樣品反應,需要硫酸的質量都相等。從鈉元素質量守恒的角度解釋其原因是: 。
【解析】[進行猜想]生成氫氧化鈣的方程式為CaO+H2O═Ca(OH)2 生成碳酸鈉的方程式為2NaOH+CO2═Na2CO3+H2O
[探究過程]
(1)將固液分離的操作為過濾,酚酞變紅了,說明溶液顯堿性,故溶液中一定含有OH—
(2)能與氯化鈣反應的是碳酸鈉,其反應方程式為Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于試管中滴加碳酸鈉溶液,有白色沉淀生成,則說明CaCl2溶液已過量
[實驗結論]因為加水后燒杯壁變熱說明樣品中含有氫氧化鈉或者是氧化鈣,或者是二者都有,加入氯化鈣生成白色沉淀說明樣品中一定含有碳酸鈉,綜合以上分析,故選②③
[拓展延伸]
(1)根據質量守恒定律可求出反應產生的CO2的質量為200g+200g-395.6g=4.4g
(2)根據二氧化碳的質量為4.4克就可以計算了,根據化學反應方程式計算,即可得出樣品中碳酸鈉的質量,繼而得出原樣品中氫氧化鈉的質量,具體步驟見答案。
(3)氫氧化鈉和碳酸鈉都是每46g鈉元素生成142g硫酸鈉,消耗98g硫酸
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com