某興趣小組在復習鐵的冶煉時,在參考資料上發現以下一段文字:已知在不同的溫度下,CO與鐵的氧化物反應能生成另一種鐵的氧化物(或鐵單質)和CO
2.他們不禁產生了疑問:課本上冊124頁的實驗中,CO與Fe
2O
3反應生成的黑色物質真的是Fe粉嗎?于是他們進行了以下探究.
[查閱資料]
資料一:Fe粉和Fe
3O
4粉末能被磁鐵吸引而FeO(黑色)不能;
資料二:Fe
3O
4中鐵元素有+2、+3兩種化合價,其化學式可用FeO?Fe
2O
3 的形式表示;
[提出猜想]黑色物質可能是Fe
3O
4、FeO和Fe粉中的一種或幾種.
[進行實驗]興趣小組收集了CO與Fe
2O
3反應生成的黑色物質進行了下列實驗:
|
實驗方案 |
實驗現象 |
| 甲 |
取少量黑色物質用磁鐵吸引 |
黑色物質全部被磁鐵吸引 |
| 乙 |
取少量黑色物質加入30%熱的鹽酸中 |
無氣泡、溶液顏色變成黃綠色 |
| 丙 |
取少量黑色物質加入硫酸銅溶液中 |
無任何現象 |
[實驗結論]
(1)甲實驗現象說明黑色物質中沒有
FeO
FeO
,乙、丙實驗現象說明黑色物質中沒有
Fe
Fe
;
(2)生成的黑色物質應為Fe
3O
4;
(3)寫出黑色粉末和熱的鹽酸反應的化學方程式
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
;
[拓展探究]同學們對Fe
3O
4產生了興趣,從參考資料中找到了氧化沉淀法生產復印用高檔Fe
3O
4粉的工藝流程簡圖.
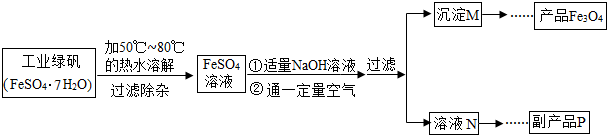
[生產流程]
[查閱資料]
資料一:硫酸亞鐵在不同溫度下的溶解度如表所示:
| 溫度/℃ |
0 |
10 |
30 |
50 |
60 |
70 |
80 |
90 |
| 溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.3 |
33.0 |
30.5 |
27.0 |
資料二:Fe(OH)
2受氧氣氧化反應原理為:4Fe(OH)
2+2H
2O+O
2=4Fe(OH)
3資料三:獲得Fe
3O
4的反應原理為:Fe(OH)
2+2Fe(OH)
3Fe
3O
4+4H
2O
[問題討論]
(1)溶解時,用50℃至80℃的熱水目的是
在50℃~80℃時,硫酸亞鐵的溶解度較大,有利于溶解的更多,提高產率
在50℃~80℃時,硫酸亞鐵的溶解度較大,有利于溶解的更多,提高產率
.
(2)寫出加入適量NaOH溶液時發生反應的化學方程式
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
.
(3)上述過程中,要控制“通一定量空氣”的目的是
控制Fe(OH)2轉化為Fe(OH)3的量
控制Fe(OH)2轉化為Fe(OH)3的量
.
(4)要使四氧化三鐵的產率最高,則上述流程中產生的Fe(OH)
2和Fe(OH)
3的最佳質量比為
90:214
90:214
.
(5)副產品P是硫酸鈉,由溶液N獲得該副產品的操作順序是b→
c
c
→
a
a
→d.
a.過濾 b.加熱濃縮 c.冷卻結晶 d.晶體加熱至完全失去結晶水
[組成確定]為確定用以上方法制得的四氧化三鐵中可能含有的雜質,同學們又進行了下列實驗探究.
[查閱資料]
資料一:難溶性堿受熱時能分解產生金屬氧化物和水(反應中各種元素的化合價不變);
資料二:Fe
2O
3和CO反應是隨溫度升高而逐步進行的,先生成Fe
3O
4,再生成FeO(黑色),最后生成Fe;
[提出猜想]Fe
3O
4中可能含有的雜質是Fe
2O
3和FeO中的一種或兩種.
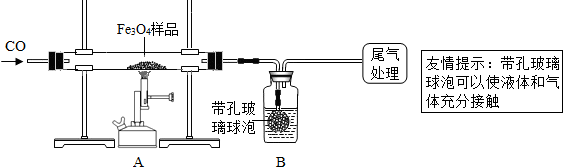
[實驗設計]同學們稱取了23.28g該Fe
3O
4樣品進行了下列實驗:
[實驗分析]因探究思路不同,興趣小組分成甲、乙兩小組.
甲組:
(1)該組同學欲通過B裝置反應前后的質量變化來計算確認該Fe
3O
4樣品中的雜質.
B中的最佳試劑是
②
②
(填序號)
①澄清石灰水 ②氫氧化鈉濃溶液 ③稀鹽酸 ④水
(2)上述實驗過程中,CO氣體除作為反應物外,能起到的作用是:
①實驗開始時,排盡裝置中的空氣,防止
防止爆炸
防止爆炸
;
②停止加熱后,繼續通CO氣體,防止
防止生成物被氧化
防止生成物被氧化
,以及B中的溶液倒吸入A中;
在本實驗中,CO氣體還能起到的作用是③
讓二氧化碳全部進入B瓶中
讓二氧化碳全部進入B瓶中
.
(3)尾氣如何處理?
點燃
點燃
.
乙組:
利用儀器測定并繪制成反應過程中A裝置中玻璃管內的固體質量隨溫度的變化曲線(如圖)
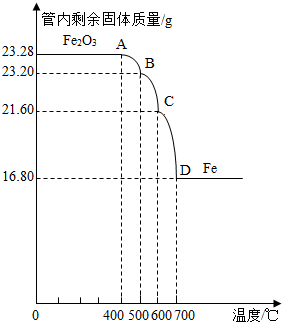
(1)寫出BC段發生反應的化學方程式:
;
(2)通過分析計算確定:該Fe
3O
4樣品中含有的雜質是
Fe2O3
Fe2O3
.(不需要寫過程)





