
題目列表(包括答案和解析)
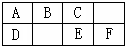 如圖是元素周期表中短周期的一部分,B、C、D、F四種元素的原子核外最外層電子數之和等于C、D元素的原子序數之和.下列說法不正確的是( )
如圖是元素周期表中短周期的一部分,B、C、D、F四種元素的原子核外最外層電子數之和等于C、D元素的原子序數之和.下列說法不正確的是( )為了探究銅與濃硫酸的反應,某研究性學習小組做了如下實驗:
①在放有銅片的圓底燒瓶中加入10 mL濃硫酸,加熱煮沸10 min(如上圖所示)后,所得固體分離除去未反應的銅片,再經水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入幾滴濃硝酸,產生大量紅棕色氣體。
③取少量不溶物,向其中加5 mL酒精,充分振蕩后,靜置、過濾,把濾液移入盛有水的小試管中,振蕩,出現渾濁。
④取少量不溶物,向其中加入3 mL氨水,振蕩,溶液呈無色,在空氣中靜置,溶液變為深藍色。
⑤取少量不溶物,向其中加入濃鹽酸并加熱,沉淀幾乎全部溶解。
為了解釋上述現象,學習小組通過查閱資料了解到:
| a.銅與濃硫酸反應的不溶性副產物可能有:CuS、Cu2S、Cu2O、S等物質; b.CuS和Cu2S都能溶于熱的濃鹽酸; c.Cu2O能溶于氨水生成無色的[Cu(NH3)2]+, [Cu(NH3)2]+在氨水中被空氣中的氧氣氧化成深藍色的[Cu(NH3)4]2+。 |
回答下列問題:
(1)第②步操作要注意的問題是____________ ;對比①②兩步操作中的現象,你能得到的結論是____________ 。
(2)第③步操作中出現的沉淀是____________ ,請解釋出現這一現象的原因____________ 。
(3)寫出④步涉及的離子方程式____________ 。
(4)綜合分析銅與濃硫酸的反應,生成的不溶物是____________。
有三種透明、不溶于水的堅硬固體,A固體在純O2中燃燒只得到一種氣體產物X,該無色氣體是相同狀況下空氣密度的1.52倍。B固體能溶于熱的燒堿溶液得到溶液Y,向Y溶液中加入過量鹽酸時,析出白色膠狀沉淀Z;將B與石灰石、純堿按一定比例混合加熱至高溫能得到C,C無固定的熔點。則
A為_______________,B為______________,C為_______________。
有A、B、C三種不溶于水的固體。A是某元素的一種單質,它在氧氣中完全燃燒得到一種無色氣體,此氣體能使澄清石灰水變渾濁,另外測得這種氣體密度為同溫、同壓下氧氣密度的1.375倍。B固體能溶于熱氫氧化鈉溶液,再往所得溶液中加入過量鹽酸時,析出白色膠狀沉淀。此沉淀干燥后,成為不溶于水的白色粉末,這是一種比碳酸酸性還弱的酸。將B與石灰石、純堿按比例混合加熱得到C,C在高溫時軟化,無固定熔點。
根據以上事實,判斷A為哪種元素的單質?B、C各是什么物質?寫出有關反應的化學方程式。
下圖是元素周期表中短周期的一部分,B、C、D、F四種元素的原子核外最外層電子數之和等于C、D元素的原子序數之和。下列說法不正確的是
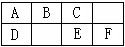
A.E元素形成的氣態氫化物分子是極性分子
B.因為E元素的非金屬性弱,故其氫化物的水溶液呈弱酸性
C.EF2分子中各原子的最外層均滿足8電子穩定結構
D.A的單質能溶于熱的E的最高價氧化物的水化物的濃溶液中
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com