
題目列表(包括答案和解析)
鋰電池技術是新能源汽車的核心技術。下面是鋰電池工作原理示意圖:

左邊是橄欖石結構的LiFePO4作為電池的正極,由鋁箔與電池正極連接,中間是聚合物的隔膜,它把正極與負極隔開,Li+可以自由通過而 電子e-不能通過,右邊是由石墨和Li組成的電池負極,由銅箔與電池的負極連接。電池的上下端之間是電池的電解質,電解質通常是LiClO4、LiAlCl4、LiAsF4等鋰鹽,溶劑通常用環脂、直鏈脂及酰胺等有機溶劑和一些非水無機溶劑。電池由金屬外殼密閉封裝。
請回答下列問題:
(1)鋰電池比容量特別大的原因是: 。
(2)鋰電池中的電解質溶液需用非水溶劑配制,為什么這種電池不能使用電解質的水溶液?請用化學方程式表示其原因: 。
(3)某鋰電池的電池反應方程式是Li+MnO2=LiMnO2。下列有關說法錯誤的是_________(填字母,下同)。
A.它的負極是鋰
B.MnO2在電極反應中被還原
C.當有3.01×1023 個電子轉移時,正極消耗1mol MnO2
D.配制鋰電池中的電解質溶液可用直鏈脂等有機物作溶劑
(4)另有一種鋰電池是將四氯鋁鋰溶解在亞硫酰氯(SOCl2)中作電解質溶液,電池總反應方程式為:8Li+3SOCl2=6LiCl+Li2SO3+2S
已知亞硫酰氯和AlCl3??6H2O混合共熱蒸干,可制得無水氯化鋁AlCl3,則下列敘述正確的是____________。
A.電解質溶液中混入水,對電池反應無影響
B.金屬鋰作電池的正極,石墨作電池的負極
C.電池工作過程中,SOCl2被還原為Li2SO3
D.電池工作過程中,金屬鋰提供的電子與正極區析出的S的物質的量之比為4:1
| 放電 |
| 充電 |
2- 4 |
| 放電 |
| 充電 |
 有些化學反應的化學能能直接轉化成電能
有些化學反應的化學能能直接轉化成電能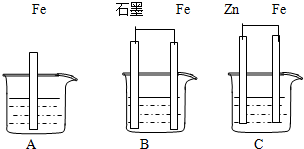
| 放電 | 充電 |
有些化學反應的化學能能直接轉化成電能
I.利用 Fe + CuSO4 = FeSO4 + Cu反應,設計一個原電池:
(1)在下框中畫出裝置圖(標明電解質溶液、正、負極和電極材料)

(2)下列說法中,正確的是 。(填字母)
A.電解質溶液中陽離子向負極移動 B.電子通過外導線由負極流向正極
C.當導線中有1mol電子通過時,理論上正極放出1g氣體
D.若所選電極的質量相等,理論上兩極質量差為60g,導線中有1 mol電子通過
II.三套裝置如下圖所示, A、B、C燒杯中分別盛有相同物質的量濃度的稀硫酸。
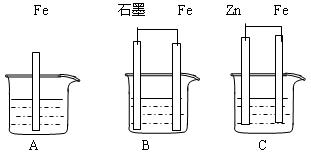
(1)比較A、B、C中鐵被腐蝕的速率,由快到慢的順序為 ;
(2)若C中電解質溶液是氯化鈉溶液,則Fe電極的電極反應式為 ;
III.目前常用的鎳(Ni)鎘(Cd)電池,其電池總反應可以表示為:
![]()
已知Ni(OH)2和Cd(OH)2均難溶于水但能溶于酸。
(1)以下說法中正確的是
①以上反應是可逆反應 ②以上反應不是可逆反應
③充電時化學能轉變為電能 ④放電時化學能轉變為電能
(2)廢棄的鎳鎘電池已成為重要的環境污染物,資料表明一節廢鎳鎘電池可以使一平方米面積的耕地失去作用價值。在酸性土壤中這種污染特別嚴重,這是因為
(3)另一種常用的電池是鋰電池,鋰是一種堿金屬元素,其相對原子質量為7,由于它的比容量(單位質量電極材料所能轉換的電量)特別大而廣泛應用于心臟起搏器,一般使用時間可長達十年,它的負極用金屬鋰制成,電池總反應可表示為Li+ MnO2 = LiMnO2。
鋰電池中的電解質溶液需用非水溶劑配制,為什么這種電池不能使用電解質的水溶液(請用化學方程式表示其原因) 。


湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com