
題目列表(包括答案和解析)
A、B、C、D、E、F六種物質的相互轉化關系如下圖所示(反應條件未標出),其中反應①是置換反應。
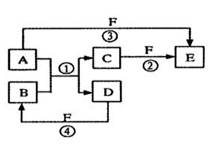
(1)若A、D、F都是非金屬單質,且A、D所含元素同主族,A、F所含元素同周期,則反應①的化學方程式是________ ___。
(2)若A是常見的金屬單質,D、F是氣態單質,反應①②均在水溶液中進行的,則E的水溶液顯 性(填“酸”“堿”或“中”),其原因是(用離子方程式表示) ;已知1 g D與F反應生成B時放出92.3 kJ熱量,寫出該反應的熱化學方程式_____________ _____。
(3)若B、C、F都是氣態單質,且B有毒,③和④兩個反應中都有水生成,反應②需要放電才能發生, A、D相遇有白煙生成, 則反應①的化學方程式是 _______。
(4)若A、D為短周期元素單質,且所含元素的原子序數A是D的2倍,所含元素的原子核外最外層電子數D是A的2倍,③和④兩個反應中都有紅棕色氣體生成,則反應①化學方程式為______ _______ 反應③中氧化劑與還原劑的物質的量之比為 _________________。
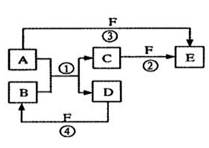
A、B、C、D、E、F六種物質的相互轉化關系如下圖所示(反應條件未標出),其中反應①是置換反應。
(1)若A、D、F都是非金屬單質,且A、D所含元素同主族,A、F所含元素同周期,則反應①的化學方程式是________ ___。
(2)若A是常見的金屬單質,D、F是氣態單質,反應①②均在水溶液中進行的,則E的水溶液顯 性(填“酸”“堿”或“中”),其原因是(用離子方程式表示) ;已知1 g D與F反應生成B時放出92.3 kJ熱量,寫出該反應的熱化學方程式_____________ _____。
(3)若B、C、F都是氣態單質,且B有毒,③和④兩個反應中都有水生成,反應②需要放電才能發生, A、D相遇有白煙生成, 則反應①的化學方程式是 _______。
(4)若A、D為短周期元素單質,且所含元素的原子序數A是D的2倍,所含元素的原子核外最外層電子數D是A的2倍,③和④兩個反應中都有紅棕色氣體生成,則反應①化學方程式為______ _______ 反應③中氧化劑與還原劑的物質的量之比為 _________________。
能源短缺是人類社會面臨的重大問題,利用化學反應可實現多種形式的能量相互轉化。請回答以下問題:
(1)由氣態基態原子形成1mol化學鍵釋放的最低能量叫鍵能。從化學鍵的角度分析,化學反應的過程就是舊鍵斷裂和新鍵的形成過程。已知反應N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。試根據表中所列鍵能數據,計算a 的數值為_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。試根據表中所列鍵能數據,計算a 的數值為_______kJ/mol。
|
化學鍵 |
H-H |
N-H |
N≡N |
|
鍵能/kJ·mol-1 |
436 |
a |
945 |
(2)甲醇是一種可再生能源,具有廣泛的開發和應用前景。已知在常壓下有如下變化:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
② H2O(g)=H2O(l) ΔH =b kJ/mol
寫出液態甲醇完全燃燒生成二氧化碳和液態水的熱化學方程式: 。
(3)可利用甲醇燃燒反應設計一個燃料電池。如下圖1,用Pt作電極材料,用氫氧化鉀溶液作電解質溶液,在兩個電極上分別充入甲醇和氧氣。
①寫出燃料電池正極的電極反應式 。②若利用該燃料電池提供電源,與圖1右邊燒杯相連,在鐵件表面鍍銅,則鐵件應是 極(填”A”或”B”);當鐵件的質量增重6.4g時,燃料電池中消耗氧氣的標準狀況下體積為 L。

(4)如果模擬工業上離子交換膜法制燒堿的方法,那么可以設想用如圖2裝置電解硫酸鉀溶液來制取氫氣、氧氣、硫酸和氫氧化鉀(電解槽內的陽離子交換膜只允許陽離子通過,陰離子交換膜只允許陰離子通過)。
①該電解槽的陽極反應式為 ,單位時間內通過陰離子交換膜的離子數與通過陽離子交換膜的離子數的比值為 。
②從出口D導出的溶液是 (填化學式)。
1
2
3
4
5
6
7
8
C
D
D
D
C
B
B
D
9
10
11
12
13
14
D
BC
BC
B
AB
CD
15.(10分) (1)① 氟離子 結構示意圖 (1分)
② 取形狀大小相同的鎂片和鋁片分別與體積相同、濃度相同的稀鹽酸反應,觀察產生氣泡的快慢 (2分)(操作1分,觀察指標1分。著重號部分缺一處扣1分。用金屬與沸水反應、等濃度鹽溶液堿性比較等合理方法均得分,方案無可行性不給分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化學式錯得0分,配平錯扣1分)
有白色膠狀沉淀生成,有無色刺激性氣味氣體產生 (2分)
(各占1分,著重號部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 強 (1分)
16.(11分)(1)除去表面的油污 CO32- + H2O  HCO3- + OH- (2分)
HCO3- + OH- (2分)
(2)不再有氣泡產生(或只有極少量氣泡產生) (1分)
(3)若控制不準確溫度過高Fe2+易被氧化;由于有氫氣生成,明火加熱不安全
(兩個方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化學式錯得0分,配平錯扣1分)
(5)6.6 (2分) (多寫單位g不扣分)
(6)循環使用 (2分(具體說出如何循環使用同樣得分,意思相近表達欠清晰扣1分)
17.(11分)
(1)2MnO4- +
5H
(化學式錯得0分,配平錯扣1分,漏↑扣1分,扣完為止)
(2)4 (2分)
(3)① 反應開始時:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反應時間: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反應速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成計算且結果正確得3分,結果錯誤得0分。速率單位錯誤扣1分)
② 否(或:不可行) (1分) 取過量的體積相同、濃度不同的草酸溶液分別同時與體積相同、濃度相同的高錳酸鉀酸性溶液反應。(3分)
(基本思路錯誤得0分,思路正確未強調草酸過量扣1分,未強調體積相同扣1分)
18


19.(12分)(1)增大 (1分)(2)不移動 (1分)(3)(4分)(各占2分,起點位置、曲線走勢、終點與原曲線的相對高低等只要有一處錯誤則得0分。)
(4)(4分)0.60(2分) ν正_>_ν逆(2分)
(5)-787.0 (2分)(不帶負號得0分,有效數字不準確扣1分。)
20.(每空2分,共10分)
(1) (2分) (2)均為氧化還原反應 (2分)
(2分) (2)均為氧化還原反應 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+6H++3NO3-=Fe3++3NO2↑+3 H2O
3 Fe+8H++2NO3-=3Fe2++2NO ↑+4H2O (共2分)
(5)取少量樣品于試管中,加入KSCN溶液,如果出現紅色,說明變質;反之,沒有變質 (2分)
21(1)a、d(1分); (2)3:2:3(1分); (3)C3H4O4(1分);


 (4)
+ CH2(COOH) 2
+H2O(2分)
(4)
+ CH2(COOH) 2
+H2O(2分)
(5)4種 (2分) (寫出下列四種結構中的任意一種均可得2分)
 |
22.(10分)(1) C F (2分) (漏選1個扣1分,多選一個也扣1分,扣完為止。)
(2)① 3 (1分) 2 (1分)
② HCO3-中含有O-H鍵,相互之間可通過O-H┅O氫鍵締合(1分)
(寫出HCO3-化學式并指出離子之間有氫鍵作用才能得分)
(3)斷裂C≡O中的一個π鍵消耗的能量是273kJ/mol,斷裂N≡N中的一個π鍵消耗的能量是523.3kJ/mol, 斷裂一個π鍵CO比N2更容易,所以CO更活潑。(2分)
 (敘述清楚,未具體計算出數值不扣分。)
(敘述清楚,未具體計算出數值不扣分。)
(4)① 1s22s22p63s23p63d84s2 (1分)
② 分子晶體 (1分)
③ (1分)
23.(10分) (1)FeC2O4?2H2O FeC2O4+2H2O,加熱 減少的質量等于所含結晶水的質量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3
FeC2O4+2H2O,加熱 減少的質量等于所含結晶水的質量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3 4Fe3O4+O2↑
4Fe3O4+O2↑
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com